
【题目】在一定温度下的密闭容器中发生反应:2X(g)+Y(g) ![]() 2Z(g), 平衡后的某一时刻(t1)改变了外界条件,其反应速率随时间的变化图像如图所示,则下列说法符合该图像的是( )
2Z(g), 平衡后的某一时刻(t1)改变了外界条件,其反应速率随时间的变化图像如图所示,则下列说法符合该图像的是( )
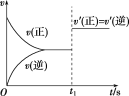
A.t1时刻,增大了X的浓度
B.t1时刻,升高了体系温度
C.t1时刻,缩小了容器体积
D.t1时刻,使用了催化剂
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:
【题目】已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12。某溶液中含有Cl-、Br-和CrO42—,浓度均为0.010 mol·L-1,向该溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )
A.Cl-、Br-、CrO42—B.CrO42—、Br-、Cl-C.Br-、Cl-、CrO42— D.Br-、CrO42—、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,可逆反应2NO2![]() 2NO+O2在体积固定的密闭容器中反应,达到平衡状态的标志是( )
2NO+O2在体积固定的密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n mol O2,同时生成2n mol NO2
②单位时间内生成n mol O2,同时生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1
④混合气体的压强不再改变
⑤混合气体的颜色不再改变
⑥混合气体的平均相对分子质量不再改变
A.①④⑤⑥B.①②③⑤C.②③④⑥D.以上全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃、101 kPa下,碳、氢气、甲烷和葡萄糖燃烧热的焓变依次是-393.5 kJ/mol、-285.8 kJ/mol、-890.31 kJ/mol、-2 800 kJ/mol,则下列热化学方程式正确的是( )
A.C(s)+![]() O2(g)=CO(g) ΔH=-393.5 kJ/mol
O2(g)=CO(g) ΔH=-393.5 kJ/mol
B.2H2(g)+O2(g)=2H2O(g) ΔH=-571.6 kJ/mol
C.CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.31 kJ/mol
D.![]() C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l) ΔH=-1 400 kJ/mol
C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l) ΔH=-1 400 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将Cl2缓慢通入水中至饱和,然后向其中滴加0.1mol/LNaOH溶液。整个实验过程中溶液的pH变化曲线如图所示,不考虑次氯酸分解,下列叙述正确的是

A.实验过程中用pH试纸测定溶液的pH
B.a~b段,溶液中![]() 减小
减小
C.b点对应溶液中:c(Cl-)>c(H+)>c(HClO)>c(ClO-)>c(OH-)
D.c点对应溶液中:c(Na+)=c(Cl-)+c(ClO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行
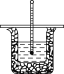
中和反应。通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
(1)从实验装置上看,图中缺少的一种玻璃用品是_____________。
(2)实验中改用60 mL 0.50 mol/L盐酸与60 mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量____(填“相等”或“不相等”),所求得的中和热____(填“相等”或“不相等”),简述理由:___________________________________________。
(3)实验中改用6.94 mL 15 mol/L硫酸溶液跟60 mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所求中和热________(填“相等”或“不相等”),简述理由:_____________________________________________________________________
(4)若三次平行操作测得数据中起始时盐酸与烧碱溶液平均温度相同,而终止温度与起始温度差(t2-t1)分别为①3.3 ℃、②3.5 ℃、③4.5 ℃,则最终代入计算式的温差平均值为____℃。
(5)请利用上(4)小题的结论,计算该实验测得的中和反应反应热ΔH=____[设盐酸和NaOH溶液的密度为1 g/cm3,反应后混合溶液的比热容(c)为4.18 J/(g·℃)]。
(6)若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和反应反应热为ΔH1,则ΔH1与原题中ΔH的关系为ΔH1____(填“<”“>”或“=”)ΔH,理由是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.水的离子积![]() 只与温度有关,但外加酸、碱、盐一定会影响水的电离程度
只与温度有关,但外加酸、碱、盐一定会影响水的电离程度
B.![]() 不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关
不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关
C.常温下,在![]() 的
的![]() 溶液中加入少量
溶液中加入少量![]() 晶体,能使溶液的pH减小,
晶体,能使溶液的pH减小, 的比值增大
的比值增大
D.室温下,![]() 的
的![]() ,
,![]() 的
的![]() ,
,![]() 溶液中的c
溶液中的c![]() 与
与![]() 中的
中的![]() 相等
相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中.下列分析正确的是( )
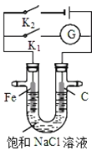
A.K1闭合,石墨棒周围溶液pH逐渐降低
B.K1闭合,铁棒上发生的反应为2H+ + 2e= H2↑
C.K2闭合,铁棒不会被腐蚀,属于牺牲阳极保护法
D.K2闭合,电路中通过0.2NA个电子时,两极共产生标况下4.48L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,可逆反应 2NO2(g)![]() 2NO(g)+O2(g)在体积固定的密闭容器中反应, 达到平衡状态的标志是( )
2NO(g)+O2(g)在体积固定的密闭容器中反应, 达到平衡状态的标志是( )
①单位时间内生成 n mol O2,同时生成 2n mol NO2
②v 正(NO)=v 逆(NO2)
③每消耗 32g 氧气,同时生成 60g NO
④混合气体的压强不再改变
⑤混合气体的颜色不再改变
⑥混合气体的平均相对分子质量不再改变
⑦混合气体的密度不再改变
A.①④⑤⑥B.①②③⑤C.①②③④⑤D.①②③④⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com