
| A. | Ca2+、K+、CO32-、OH- | B. | Na+、Ba2+、SO4 2-、NO3-- | ||
| C. | K+、Cu2+、Cl-、SO42- | D. | Na+、Mg2+、Cl-、ClO- |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 实验室用如图所示的装置进行中和热测定实验.下列说法正确的是( )
实验室用如图所示的装置进行中和热测定实验.下列说法正确的是( )| A. | 用强酸和弱碱进行实验,测定的中和热(△H)一定为-57.3kg/mol | |
| B. | 实验过程中,将50mL 0.55mol/L的NaOH溶液逐滴加入到50mL 0.5mol/L的盐酸中 | |
| C. | 实验前用温度计先测量盐酸温度,再用该温度计直接测量NaOH溶液的温度 | |
| D. | 该实验需要计算生成水的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若硝酸有剩余,溶液中存在的金属阳离子有Fe2+、Cu2+ | |
| B. | 若硝酸有剩余,溶液中存在的金属阳离子可能是Fe3+、Cu2+ | |
| C. | 若金属与硝酸均无剩余,溶液中存在的金属阳离子有Fe3+、Fe2+、Cu2+ | |
| D. | 若金属有剩余,剩余金属中一定有铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 爱氏试剂(由质量分数为25%盐酸、96%乙醇与无水乙醚以体积之比为1:3:1配成的混合溶液)是工商部分用于检验猪肉(含N元素)是否变质(如图)的试剂,若观察到有白烟出现,则说明猪肉已变质.下列有关说法正确的是( )
爱氏试剂(由质量分数为25%盐酸、96%乙醇与无水乙醚以体积之比为1:3:1配成的混合溶液)是工商部分用于检验猪肉(含N元素)是否变质(如图)的试剂,若观察到有白烟出现,则说明猪肉已变质.下列有关说法正确的是( )| A. | 白烟的成分为NH4Cl | |
| B. | 可用稀硫酸代替盐酸 | |
| C. | 腐败肉样释放出的是N2 | |
| D. | 该检验可直接将肉样放入爱氏试剂中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=2的硫酸溶液含有H+数目为0.0lNA | |
| B. | 该反应释放SO2分子数目为$\frac{V}{22.4}$NA | |
| C. | 反应中每摩尔Na2S2O3转移的电子数目为4NA | |
| D. | 若98gH2SO4溶于水完全电离,其断裂的共价键数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
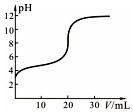 25℃时,用0.1000mol•L-1 KOH溶液滴定20.00mL 0.1000mol•L-1 CH3COOH溶液,滴定中pH变化如图,下列关系错误的是( )
25℃时,用0.1000mol•L-1 KOH溶液滴定20.00mL 0.1000mol•L-1 CH3COOH溶液,滴定中pH变化如图,下列关系错误的是( )| A. | V=0.00 mL时,CH3COOH溶液pH=3,其电离平衡常数K≈10-5mol•L-1 | |
| B. | V=10.00 mL时,溶液中c(CH3COO-)>c(K+)>c(H+)>c(OH-) | |
| C. | 溶液pH=7时,$\frac{c({K}^{+})•c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}$=1 | |
| D. | V≥20.00 mL时,溶液中c(K+)=c(CH3COO-)+c(OH-)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物的热稳定性:Y>Z | |
| B. | Y元素的氧化物对应的水化物一定是强酸 | |
| C. | M与R可形成含非极性键的化合物 | |
| D. | 固体X2Y3可在水溶液中制取 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu 溶于稀 HNO3:Cu+2H++NO3-═Cu2++NO2↑+H2O | |
| B. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 用CH3COOH溶解 CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | FeCl3溶液与Cu反应:2Fe3++Cu═2Fe2++Cu2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com