
【题目】在容积为2L的3个密闭容器中发生反应3A(g)+B(g) ![]() xC(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
xC(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 3molA、2molB | 6molA、4molB | 2molC |
到达平衡的时间(min) | 5 | 8 | |
A的浓度(mol/L) | c1 | c2 | |
C的体积分数 | w1 | w3 | |
混合气体密度(g/L) | ρ1 | ρ2 |
下列说法正确的是
A.若x<4,则2c1<c2
B.若w3=w1,可断定x=4
C.无论x的值是多少,均有2ρ1=ρ2
D.容器甲中反应从开始到达平衡平均速率为v(A)=0.3molL-1min-1
科目:高中化学 来源: 题型:
【题目】日常生活中,被广泛使用的某消毒液无色,pH大于7,对某些有色物质有漂白作用。该消毒液的有效成分可能是
A. NaClO B. 氯水 C. KMnO4 D. SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图Ⅰ是NO2(g)+CO(g)![]() CO2(g)+NO(g)反应过程中能量变化示意图.一定条件下,在固定容积的密闭容器中该反应达到平衡状态.当改变其中一个条件X,Y随X的变化关系曲线如图Ⅱ,下列有关说法正确的是
CO2(g)+NO(g)反应过程中能量变化示意图.一定条件下,在固定容积的密闭容器中该反应达到平衡状态.当改变其中一个条件X,Y随X的变化关系曲线如图Ⅱ,下列有关说法正确的是

A.一定条件下,向密闭容器中加入1molNO2(g)与1molCO(g)反应放出234 kJ热量
B.若X表示CO的起始浓度,则Y表示的可能是NO2的转化率
C.若X表示反应时间,则Y表示的可能是混合气体的密度
D.若X表示温度则Y表示的可能是CO2物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的水溶液: ①NaOH ②CH3COOH ③NH3 ④NaHCO3⑤Cl2 不能溶解CaCO3的是
A. ①③④ B. ①④⑤ C. ②④ D. ②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年9月3日,二十国集团领导人杭州峰会之前,中国政府率先签署了《巴黎协定》并向联合国交存批准文书,体现中国为应对全球气候变化做出了重要贡献。为减少CO2对环境造成影响,有科学家提出设想,先把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,并使之变为可再生燃料甲醇,流程如下:
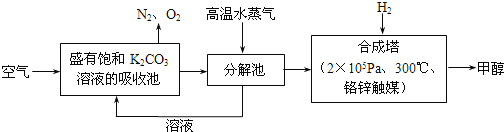
(1)写出分解池中反应的化学方程式___________________。
(2)在合成塔中,当有8.8gCO2与足量H2完全反应,可放出9.84×l03kJ的能量,写出合成塔中反应的热化学方程式______________________。
(3)在体积为l L的密闭容器中,充入1molCO2和3molH2在300℃下发生反应,有关物质的浓度随时间变化如下图所示。
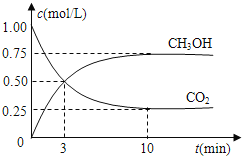
①从反应开始到平衡,H2的平均反应速率v(H2)=_______ _____。
②其他条件不变,只将温度提高到500℃,再次平衡时n(CH3OH)/n(CO2)比值___________(填“增大”、“减小”或“不变”)。
③从平衡移动原理分析,低温有利于提高原料气的转化率,而实际生产中采用300℃的温度,原因是_______________。
(4)目前,由CO2来合成二甲醚已取得了较大的进展,其化学反应是:
2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) △H>0。
CH3OCH3(g)+3H2O(g) △H>0。
判断该反应在一定条件下,体积恒定的密闭容器中是否达到化学平衡状态的依据是_________。
a.容器中密度不变
b.单位时间内消耗2molCO2,同时消耗1mol二甲醚
c.v(CO2):v(H2)=1:3
d.容器内压强保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)画出下列元素的原子结构示意图。
①核电荷数为13的元素:__________。
②某元素原子的最外层电子数等于次外层电子数:__________________ 。
③L 层电子数是M层电子数2倍的元素: ___________________ 。
④某同位素原子核内没有中子的元素: ___________________ 。
(2)写出1~18号元素中符合下列条件的原子(离子)的微粒符号和结构示意图。
①某元素原子L层上的电子数为K层的3倍: __________________ 。
②某元素原子L层上的电子数为K层的一半: _________________ 。
③得到2个电子后,电子总数与氩原子的电子总数相同的离子: ___________________ 。
④某元素原子的最外层电子数等于次外层电子数的2倍: ___________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温常压下,依据事实,写出下列反应的热化学方程式。
①在25℃、101kPa下,2g甲醇燃烧生成CO2和液态水时放热45kJ。则表示甲醇燃烧热的热化学方程式为______________________。
②若适量的N2和O2完全反应,每生成23g NO2需要吸收17kJ热量__________________。
(2)断裂1mol(理想)气体分子化学键所吸收的能量或形成1mol(理想)气体分子化学键所放出的能量称为键能(单位为KJ.mol-1)下表是一些键能数据(KJ·mol-1)
化学键 | 键能 | 化学键 | 键能 | 化学键 | 键能 | 化学键 | 键能 |
C—H | 414 | C—F | 489 | H—F | 565 | F—F | 158 |
H-H | 436 | H-N | 391 |
①根据键能数据计算以下反应的反应热△H:
CH4(g)+4F2(g)﹦CF4(g)+4HF(g) △H
②根据键能和反应热化学方程式1/2N2(g)+3/2H2(g) =NH3(g ) △H = —46 kJ·mol-1 计算N≡N的键能。
(3)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256kJ的热量(25℃、101 kPa下测得的热量)。
①该反应的热化学方程式为 。
②又已知H2O(l)=H2O(g) ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com