
【题目】如图是周期表中原子序数小于20的某些元素的单质的沸点与原子序数的关系,图中的原子序数是连续的. 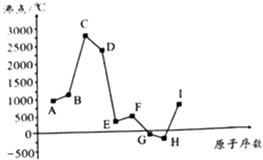
试根据图,回答下列问题:
(1)E元素在元素周期表中的位置是 .
(2)上述元素所形成的气态氢化物中最稳定的是(写化学式).
(3)上述元素中,最容易形成离子键的两种元素所形成的化合物是(写电子式).
(4)A和I两种元素相比,金属性较强的是(写元素符号),请你列举事实加以说明 .
(5)B和C的单质、A的最高价氧化物对应的水化物的水溶液三者可形成原电池,该原电池负极的电极反应式为 .
【答案】
(1)第三周期VA族
(2)HCl
(3)![]()
(4)K;钾与水反应比钠剧烈
(5)A1+4OH﹣﹣3e﹣=AlO2﹣+2H2O
【解析】解:图是周期表中原子序数小于20的9种元素单质的沸点与原子序数的关系,图中原子序数是连续的,G、H的沸点小于0℃,其它都大于250℃,且沸点G>H,则G为Cl、H为Ar,可推知A为Na、B为Mg、C为Al、D为Si、E为P、F为S、I为K.
(1.)组成E的元素为P,在周期表中的位置是:第三周期VA族,所以答案是:第三周期VA族;
(2.)组成A﹣I的元素中,Cl元素非金属性最强,氢化物最稳定的是HCl,所以答案是:HCl;
(3.)上述元素中,最容易形成离子键的两种元素所形成的化合物是KCl,其电子式为 ![]() ,所以答案是:
,所以答案是: ![]() ;
;
(4.)A和I两种元素相比,金属性较强的是K,钾与水反应比钠剧烈(或KOH的碱性强于NaOH等)可以说明K的金属性更强,所以答案是:K;钾与水反应比钠剧烈;
(5.)Mg和Al的单质、NaOH水溶液三者可形成原电池,Al与氢氧化钠溶液反应生成偏铝酸钠与氢气,Al为负极,负极的电极反应式为:A1+4OH﹣﹣3e﹣=AlO2﹣+2H2O,所以答案是:A1+4OH﹣﹣3e﹣=AlO2﹣+2H2O.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】常温下,向10mlbmol·L-1的CH3COOH溶液中滴加等体积的0.01mol·L-1的NaOH溶液,充分反应后溶液中c(CH3COO-)=c(Na+),下列说法正确的是
A. b<0.01
B. 混合后溶液呈中性
C. CH3COOH的电离常数Ka=![]()
D. 向CH3COOH溶液中滴加NaOH溶液的过程中,水的电离程度逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组为探究铁与浓硫酸反应,设计了如图所示装置进行实验。
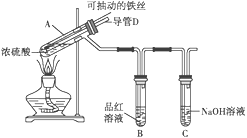
(1)已知C中盛有足量的氢氧化钠溶液,实验过程中,观察到B中的品红溶液褪色,C中发生反应的离子方程式为______________________________。一段时间后,观察到C中有少量气泡冒出,此气泡的成分是________________。
(2)用“可抽动的铁丝”代替“直接投入铁片”的优点是_____________________________;
(3)导管D作用是___________________________________________________。
(4)反应结束后,不需要打开胶塞,就可使装置中残留气体完全被吸收,应当采取的操作是_____。
(5)设计实验检验反应后试管A中所得溶液里是否含有亚铁离子,可选用的试剂为(_____)
A. NaOH溶液 B. 铁氰化钾溶液
C. KSCN溶液和双氧水 D.酸性高锰酸钾溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒压下,向密闭容器中充入4 mol SO2和2 mol O2,发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g)ΔH<0。2 min后,反应达到平衡,生成SO3为1.4 mol,同时放出热量QkJ。则下列分析正确的是
2SO3(g)ΔH<0。2 min后,反应达到平衡,生成SO3为1.4 mol,同时放出热量QkJ。则下列分析正确的是
A. 若反应开始时容器体积为2 L,则v(SO3)=0.35 mol·L-1·min-1
B. 2 min后,向容器中再通入一定量的SO3气体,重新达到平衡时,SO2的含量降低
C. 若把条件“恒温恒压”改为“恒压绝热”,则平衡后n(SO3)大于1.4 mol
D. 若把条件“恒温恒压”改为“恒温恒容”,则平衡时放出热量小于QkJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅在氧气中完全燃烧的化学方程式为:Si+O2 ![]() SiO2 , 1molSi完全燃烧生成SiO2放出992kJ的热量.已知断裂1molSi﹣Si键、1molO=O键和1molSi﹣O键吸收的能量分别为176kJ、496kJ、460kJ.晶体结构知识告诉我们,1molSiO2中含有4molSi﹣O键,则1molSi中含有Si﹣Si键的物质的量为( )
SiO2 , 1molSi完全燃烧生成SiO2放出992kJ的热量.已知断裂1molSi﹣Si键、1molO=O键和1molSi﹣O键吸收的能量分别为176kJ、496kJ、460kJ.晶体结构知识告诉我们,1molSiO2中含有4molSi﹣O键,则1molSi中含有Si﹣Si键的物质的量为( )
A.1mol
B.2mol
C.3mol
D.4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学电源在生产生活中有着广泛的应用,请回答下列问题:
(1)电动汽车上用的铅蓄电池是以一组充满海绵状态铜的铅板和另一组结构相似的充满二氧化铅的铅板组成,用H2SO4作电解液。放电时总反应为:Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O
① 写出放电时负极的电极反应式:______________________________;
② 铅蓄电池放电时,溶液的pH将_________(填增大、减小或不变)。当外电路上有0.5mol电子通过时,溶液中消耗H2SO4的物质的量为___________。
③ 放电完后,对该电池进行充电,在连接电源的负极一端生成________。(填“Pb”或“PbO2”)
(2)下图是某宇宙飞船中使用的氢氧燃料电池。其导电介质为KOH,总反应为:2H2 + O2=2H2O。
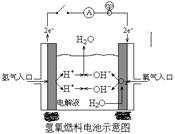
① 则负极通入的是_______,(填“H2”或“O2”)负极电极反应式为:_______________________,正极电极反应式为:______________________。
②如把导电介质改为稀H2SO4,则电极反应式为:负极__________________,正极______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①C(s)+ ![]() O2(g)═CO(g);△H=﹣110.5kJmol﹣1
O2(g)═CO(g);△H=﹣110.5kJmol﹣1
②C(s)+O2(g)═CO2(g);△H=﹣393.51kJmol﹣1
则反应C(s)+CO2(g)═2CO(g)的△H为( )
A.﹣283.01 kJmol﹣1
B.+172.51 kJmol﹣1
C.+283.01 kJmol﹣1
D.﹣172.51 kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列水作为反应物参加的反应中:①钠与水反应 ②Na2O2与水反应 ③氟气与水反应 ④电解水。按照水的作用依次是只作氧化剂、只作还原剂、既作氧化剂又作还原剂、既不作氧化剂又不作还原剂顺序排列是
A.①②③④B.①③④②C.①④②③D.①④③②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据氧化还原反应:2Ag+(aq) + Cu(s) = Cu2+(aq) + 2Ag(s)设计的原电池如图所示,请回答下列问题:
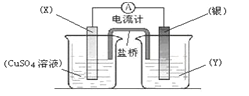
(1)电极X的材料是:________(填化学式);电解质溶液Y是:_________;
(2)银电极为电池的_______极,发生的电极反应为:___________________,X电极上发生的电极反应为:_____________________________________;
(3)外电路中的电子是从_________电极流出(填“X”或“银”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com