
【题目】已知:①C(s)+O2(g)=CO2(g)△H1
②CO2(g)+C(s)=2CO(g) △H2
③2CO(g)+O2(g)=2CO2(g) △H3
④4Fe(s)+3O2(g)=2Fe2O3(s) △H4
⑤3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) △H5
下列关于上述反应焓变的判断正确的
A.△H1>0,△H3<0
B.△H2>0,△H4>0
C.△H1=△H2+△H3
D.△H3=△H4+△H5
科目:高中化学 来源: 题型:
【题目】如图是我国学者研发的高效过氧化氢一尿素电池的原理装置:
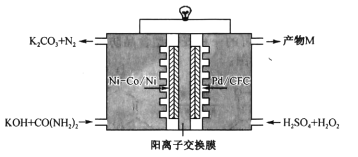
装置工作时,下列说法错误的是
A.Ni-Co/Ni极上的电势比Pd/CFC极上的低
B.向正极迁移的主要是K+,产物M为K2SO4
C.Pd/CFC极上发生反应:![]()
D.负极反应为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将 1molCaC2O4 粉末置于盛有500mL蒸馏水的烧杯中,然后向烧杯中加入Na2CO3固体(忽视溶液体积的变化)并充分搅拌,加入Na2CO3 固体的过程中,溶液中Ca2+ 和 CO32-的浓度变化曲线如图所示,下列说法中不正确的是
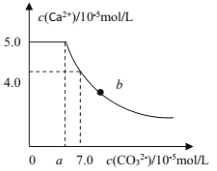
A.a=5.6
B.常温下,Ksp(CaC2O4)>Ksp(CaCO3)
C.b 点对应的溶液中,离子浓度关系为c(C2O42-) <c(CO32-)
D.若使 1molCaC2O4 全部转化为 CaCO3,至少要加入 2.12molNa2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前大多数城市采用雨污分流的排水体制,污水汇集到一起,进行集中处理。如图是电解法处理某生活污水的装置:
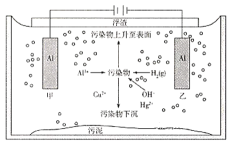
下列叙述正确的是( )
A.甲、乙两个电极均为消耗型电极,不能用石墨代替
B.电解开始时,阴极反应为2H2O+2e-=H2↑+2OH-,阴极区pH升高
C.当阳极有9.0gAl溶解时,阴极一定增重100.5g或32.0g
D.污水中污染物的除去是阳极反应与阴极反应协同作用的结果
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)某有机物的结构简式为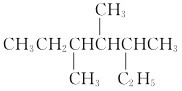
①该有机物系统命名法命名为____________ 。
②若该烷烃是由单炔烃和氢气加成得到的,则可能的单炔烃有________种。
③若该烷烃是由单烯烃和氢气加成得到的,则可能的烯烃有____种,任写一种烯烃的结构简式:________________________。
(2)某有机物只含C、H、O 三种元素,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等),该物质的结构简式为___________ 。
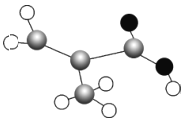
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示。下列说法正确的是

A.温度:a>b>c
B.仅升高温度,可从a点变为c点
C.水的离子积常数Kw:b>c>d
D.b点对应温度下,0.5 mol/L H2SO4溶液与1mol/L KOH溶液等体积混合,充分反应后,所得溶液中c(H+) = 1.0×10-7 mol L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)101kPa下,1g氢气完全燃烧生成液态水放出142.9kJ热量,氢气的燃烧热△H =_______;氢气燃烧的热化学方程式为_______。
(2)某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。
①倒入NaOH溶液的正确操作是________(填选项字母,下同)。
A.沿玻璃棒缓慢倒入
B.一次性迅速倒入
C.分三次少量倒入
②使硫酸与NaOH溶液混合均匀的正确操作是_______。
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(3)工业合成氨反应为N2(g)+3H2(g)2NH3(g),一定条件下,在2 L密闭容器中进行实验,测得有关数据如下表所示:
物质 | N2(g) | H2(g) | NH3(g) |
起始(mol) | 2 | 7 | 0 |
10 s(mol) | 1.6 | ||
平衡时(mol) | 2 |
则010 s内,用氢气的浓度变化表示的平均反应速率是_______,该反应的化学平衡常数是_________。根据混合气体各成分的物质性质,你认为工业上将氨气从混合气体中分离出来的措施是_______ ,从而达到反应气体循环利用的目的。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用天然气作为制备甲醇CH3OH的原料。已知:
①CH4(g)+O2(g)CO(g)+H2(g)+H2O(g)△H=-321.5kJ/mol
②CH4(g)+H2O(g)CO(g)+3H2(g)△H=+250.3kJ/mol
③CO(g)+2H2(g)CH3OH(g)△H=-90kJ/mol
(1)CH4(g)与O2(g)反应生成CH3OH(g)的热化学方程式为______。
(2)向VL恒容密闭容器中充入a mol CO与2a molH2,在不同压强下合成甲醇。CO的平衡转化率与温度、压强的关系如图所示:

①压强P1______P2(填“<”、“>”或“=”)
②在100℃、P1压强时,平衡常数为______(用含a,V的代数式表示)。
(3)甲醇燃料电池往往采用KOH(或NaOH)浓溶液作电解质溶液,电极采用多孔石墨棒,两个电极上分别通入甲醇和氧气。通入氧气的电极为:通入甲醇的电极上发生的电极反应为:______。用此燃料电池电解某浓度氯化钠溶液,电解一段时间后,收集到标准状况下氢气3.36L,此时燃料电池所消耗的CH3OH的质量为:______。
(4)常温下,0.1mol/LNaHCO3溶液的pH大于8,则溶液中C(H2CO3)______C(CO32-)(填“<”、“>”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用0.1mol/LNaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol/L的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。

①滴定醋酸的曲线是____(填“I”或“II”)。
②V1和V2的关系:V1____V2(填“>”、“=”或“<”)。
③M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是____。
(2)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。查阅资料:AgSCN是白色沉淀,相同温度下,溶解度:AgSCN>AgI。
操作步骤 | 现象 |
步骤1:向2mL0.005mol/LAgNO3溶液中加入2mL0.005mol/LKSCN溶液,静置。 | 出现白色沉淀 |
步骤2:取1mL上层清液于试管中,滴加1滴mol/LFe(NO3)3溶液。 | 溶液变红色 |
步骤3:向步骤2的溶液中,继续加入5滴3mol/LAgNO3溶液。 | 现象a,溶液红色变浅 |
步骤4:向步骤1中余下的浊液中加入5滴3mol/LKI溶液。 | 出现黄色沉淀 |
①写出步骤2中溶液变红色的离子方程式____。
②步骤3中现象a是____。
③用化学平衡原理解释步骤4的实验现象____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com