
【题目】按要求回答下列问题:
(1)某种粒子有1个原子核,核中有17个质子,20个中子,核外有18个电子,该粒子的化学符号是__。
(2)下列关于化学键的说法正确的是____。
① 含有金属元素的化合物一定是离子化合物
② 第IA族和第ⅦA族元素原子化合时,一定生成离子键
③ 由非金属元素形成的化合物一定不是离子化合物
④ 活泼金属与非金属化合时,能形成离子键
⑤ 离子键就是阴、阳离子间的相互引力
⑥离子化合物中可能含有非极性共价键
(3)写出下列物质的电子式:Mg(OH)2:____, N2:_______,NH4I:_______。
(4)用电子式表示下列化合物的形成过程:Na2S:_______;H2O:_______。
【答案】![]() ④⑥
④⑥ ![]()
![]()

![]()
![]()
【解析】
(1)某种粒子有1个原子核,核中有17个质子,20个中子,核外有18个电子,该粒子电子数比质子数多1个,为带1个单位负电荷的阴离子,核中有17个质子,则为![]() ;
;
(2)① 含有金属元素的化合物不一定是离子化合物,如AlCl3为共价化合物,①错误;
② 第IA族和第ⅦA族元素原子化合时,不一定生成离子键,如HCl,②错误;
③ 由非金属元素形成的化合物可能是离子化合物,如NH4Cl,③错误;
④ 活泼金属与非金属化合时,能形成离子键,如NaCl、KI等,④正确;
⑤ 离子键就是阴、阳离子间的相互作用,既有引力又有斥力,⑤错误;
⑥离子化合物中可能含有非极性共价键,如Na2O2,⑥正确;
故答案为:④⑥;
(3)Mg(OH)2:由Mg2+和OH-构成,电子式为![]() ;
;
N2:两个N原子间形成三对共用电子,电子式为![]() ;
;
NH4I:由NH4+和I-构成,电子式为 ;
;
(4)Na2S:![]() ;
;
H2O:![]() 。
。


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】按图的装置进行电解实验:A极是铜锌合金,B极为纯铜,电解质中含有足量的铜离子。通电一段时间后,若A极恰好全部溶解,此时B极质量增加7.68g,溶液质量增加0.03g,则A合金中Cu、Zn原子个数比为( )

A. 4︰1B. 3︰1C. 2︰1D. 任意比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1906年,哈伯在60℃高温、200兆帕高压的条件下,用锇(Os)作催化剂,首次成功得到了氨,但产率较低。随着科学的进步以及科学家们对催化剂的研究改进,现在工业上普遍采用铁触媒(主要成分为Fe3O4,助催化剂:K2O、Al2O3、CaO、MgO、CoO等)做合成氨的催化剂,大大提高了合成氨的产率。回答下列问题:
(1)已知元素Co(钴)的原子核内有27个质子,则该元素基态原子价电子排布式为___。
(2)元素Fe的基态原子核外未成对电子数为___;Fe2+与Fe3+相比较,___更稳定。
(3)C、N、O处于同一周期,其中第一电离能最大的___,电负性最大的是___,它们与氢形成的简单氢化物沸点从高到低的顺序为___。
(4)NH3分子中N原子的杂化方式为___;氨气极易溶于水(溶解度1:700),除了氨气能与水发生反应外,还有两个原因分别是___、___。
(5)我国长征系列运载火箭使用的液态燃料主要是偏二甲肼[结构简式:(CH3)2NNH2,可看作是肼(NH2NH2)中同一氮原子上的两个氢原子被甲基取代]和四氧化二氮,燃烧时发生反应:(CH3)2NNH2+2N2O4=2CO2+4H2O+3N2。当该反应消耗1molN2O4时将形成___molπ键。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计如下微型实验装置。实验时,现断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表指针偏转,下列有关描述正确的是

A. 断开K2,闭合K1时,总反应的离子方程式为:2H++2Cl—![]() Cl2↑+H2↑
Cl2↑+H2↑
B. 断开K2,闭合K1时,石墨电极附近溶液变红
C. 断开K1,闭合K2时,铜电极上的电极反应为:Cl2+2e—=2Cl—
D. 断开K1,闭合K2时,石墨电极作正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Y是一种药物中间体,可由X制得:
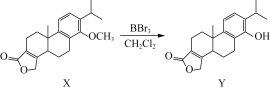
下列有关化合物X、Y的说法正确的是( )
A.Y分子中五元环上的4个碳原子一定共平面
B.1 mol X最多能与2 mol Br2反应
C.用FeCl3溶液可鉴别化合物X和Y
D.X、Y在酸性条件下的水解产物均能发生氧化反应、加成反应、消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌钡白ZnS·BaSO4是一种常用白色颜料,以重晶石(BaSO4)和焦炭粉为原料,在回转炉中强热制取可溶性硫化钡。硫化钡在净化后形成溶液,再与硫酸锌经过一系列过程最终制得锌钡白成品。
(1)回转炉中发生反应的化学方程式为___________________________。
(2)回转炉尾气中含有有毒气体,生产上通入一定量的水蒸气进行处理,水蒸气的作用是_____________________________。
(3)成品中S2-的含量可以用“碘量法”测得。称取m g样品,置于碘量瓶中,移取25.00 mL 0.1000 mol·L-1的I2-KI溶液于其中,并加入乙酸溶液,密闭,置暗处反应5 min,有单质硫析出。以淀粉溶液为指示剂,过量的I2用0.1000 mol·L-1Na2S2O3溶液滴定,反应式为I2+2S2O32-=2I-+S4O62-。测定时消耗Na2S2O3溶液体积V mL,滴定终点现象为__________,样品中S2-的含量为____________(写出表达式与计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子工业上使用的印刷电路板,是在敷有铜膜的塑料板上以涂层保护所要的线路,然后用三氯化铁浓溶液作用掉(腐蚀)未受保护的铜膜后形成的。某工程师为了从使用过的腐蚀废液(含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费)中回收铜,并将铁的化合物全部转化为FeCl3溶液作为腐蚀液原料循环使用,准备采用下列步骤:
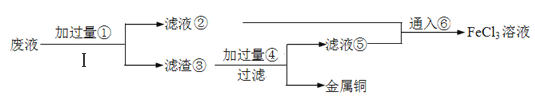
(1)步骤Ⅰ的操作名称:________;所需玻璃仪器:_________、_________、__________。
(2)写出FeCl3溶液与铜箔发生反应的离子方程式:______________________。
(3)检验废腐蚀液中是否含有Fe3+所需试剂名称:___________、实验现象:__________。
(4)向②中加入NaOH溶液并长时间暴露在空气中,此过程的现象:________________,此转化的化学方程式为:______________________________。
(5)写出③中所含物质:_________⑥发生反应的离子方程式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
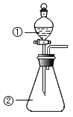
【题目】下列说法正确的是( )
A.节日里燃放的五彩缤纷的烟花是某些金属元素化学性质的展现
B.用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热,熔化后的液态铝滴落下来,说明金属铝的熔点较低
C.将等物质的量的氧化钠和过氧化钠分别投入到足量且等质量的水中,得到溶质质量分数分别是a%和b%的两种溶液,则a和b的关系是a=b
D.用如图装置进行实验,将装置①中的AlCl3溶液滴入装置②浓氢氧化钠溶液,溶液中可观察到有大量白色沉淀产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三种可溶性物质A、B、C,其中有一种是碱,两种是盐,溶于水后电离产生的离子如下表所示:
阳离子 | Na+ H+ Ba2+ |
阴离子 | OH- CO32- SO42- |
为鉴别它们,分别完成一些实验。请根据实验的结果回答下列问题:
(1)A溶液与B溶液反应可生成气体X。根据上述六种离子之间的可能反应判断X的化学式为 ,A溶液与B溶液反应的离子方程式为 。
(2)气体X可以和C溶液反应生成沉淀D,沉淀D可与B溶液反应。则C的化学式为 ,B溶于水后的电离方程式为 。
(3)B溶液与C溶液反应生成不溶于稀硝酸的白色沉淀E。B溶液与C溶液反应至中性的离子方程式为 。
(4)D与E的混合物ag,加入足量盐酸,完全反应生成的气体在标准状况下体积为bL,则求算E在混合物中的质量分数的表达式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com