
【题目】锌钡白ZnS·BaSO4是一种常用白色颜料,以重晶石(BaSO4)和焦炭粉为原料,在回转炉中强热制取可溶性硫化钡。硫化钡在净化后形成溶液,再与硫酸锌经过一系列过程最终制得锌钡白成品。
(1)回转炉中发生反应的化学方程式为___________________________。
(2)回转炉尾气中含有有毒气体,生产上通入一定量的水蒸气进行处理,水蒸气的作用是_____________________________。
(3)成品中S2-的含量可以用“碘量法”测得。称取m g样品,置于碘量瓶中,移取25.00 mL 0.1000 mol·L-1的I2-KI溶液于其中,并加入乙酸溶液,密闭,置暗处反应5 min,有单质硫析出。以淀粉溶液为指示剂,过量的I2用0.1000 mol·L-1Na2S2O3溶液滴定,反应式为I2+2S2O32-=2I-+S4O62-。测定时消耗Na2S2O3溶液体积V mL,滴定终点现象为__________,样品中S2-的含量为____________(写出表达式与计算过程)。
【答案】BaSO4+4C![]() BaS+4CO↑ 与产生的有毒气体CO反应,防止污染大气 浅蓝色褪去,且半分钟内不再恢复
BaS+4CO↑ 与产生的有毒气体CO反应,防止污染大气 浅蓝色褪去,且半分钟内不再恢复 ![]() ×100%
×100%
【解析】
(1)在回转炉中BaSO4与C在高温下反应产生BaS和CO;
(2)水蒸气与CO反应产生CO2和H2;
(3)利用I2遇淀粉溶液变为蓝色判断滴定终点;先计算出与Na2S2O3反应的过量的I2的物质的量,然后由I2的总物质的量计算出发生反应S2-+I2=S+2I-的I2的物质的量及S2-的物质的量和质量,最后根据质量分数×100%计算S2-的含量。
(1)在回转炉中BaSO4与C在高温下反应产生BaS和CO,根据电子守恒、原子守恒,可得反应的化学方程式为:BaSO4+4C![]() BaS+4CO↑;
BaS+4CO↑;
(2)回转炉尾气中含有有毒气体CO,该气体具有还原性,能够在高温下与水蒸气反应产生无毒的气体CO2和H2,因此可防止污染大气;
(3)碘遇淀粉变蓝色,当滴定达到终点时,碘完全被消耗,溶液由浅蓝色变为无色,且半分钟内不再恢复蓝色;根据方程式I2+2S2O32-=2I-+S4O62-可知与Na2S2O3反应的I2的物质的量n(I2)=![]() n(Na2S2O3)=
n(Na2S2O3)=![]() ×0.1000 mol/L×V×10-3 L,则与S2-反应的I2的物质的量n(I2)=0.1000 mol/L×25×10-3 L-
×0.1000 mol/L×V×10-3 L,则与S2-反应的I2的物质的量n(I2)=0.1000 mol/L×25×10-3 L-![]() ×0.1000 mol/L×V×10-3 L,根据S2-+I2=S+2I-,可知n(S2-)=n(I2)=0.1000 mol/L×25×10-3 L -
×0.1000 mol/L×V×10-3 L,根据S2-+I2=S+2I-,可知n(S2-)=n(I2)=0.1000 mol/L×25×10-3 L -![]() ×0.1000 mol/L×V×10-3 L,m(S2-)= n(S2-)·M=[0.1000 mol/L×25×10-3 L -
×0.1000 mol/L×V×10-3 L,m(S2-)= n(S2-)·M=[0.1000 mol/L×25×10-3 L -![]() ×0.1000 mol/L×V×10-3 L]×32 g/mol,则S2-的质量分数=
×0.1000 mol/L×V×10-3 L]×32 g/mol,则S2-的质量分数=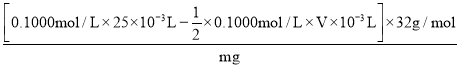 ×100%=
×100%=![]() ×100%。
×100%。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在盛有饱和硫酸钠溶液的烧杯中,保持温度不变,用惰性电极电解一定时间后( )
A. 溶液的pH值将增大B. 钠离子数和硫酸根离子数的比值将变小
C. 溶液的浓度逐渐增大,有一定量晶体析出D. 溶液的浓度不变,有晶体析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】膜技术原理在化工生产中有着广泛的应用。有人设想利用电化学原理制备少量硫酸和绿色硝化剂N205,装置图如下,下列说法正确的是( )

A. 图中B装置是原电池
B. N2O5在B池的c极区生成,其电极反应式为N2O4+2HNO3-2e-=2N2O5+2H+
C. A装置中通入O2一极的电极反应式为O2+2H2O+4e-=4OH-
D. 若A装置中通入SO2的速率为2.24Lmin-1(标准状况),为稳定持续生产,硫酸溶液的浓度应维持不变,则左侧水的流入速率应为14.6mLmin-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.NaClO(aq)![]() HClO(aq)
HClO(aq)![]() Cl2(g)
Cl2(g)
B.Fe3O4(s)![]() Fe(s)
Fe(s)![]() Fe(NO3)3(aq)
Fe(NO3)3(aq)
C.Cu(s)![]() Cu2O(s)
Cu2O(s)![]() CuSO4(aq)
CuSO4(aq)
D.S(s)![]() SO2(g)
SO2(g)![]() BaSO3(s)
BaSO3(s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)某种粒子有1个原子核,核中有17个质子,20个中子,核外有18个电子,该粒子的化学符号是__。
(2)下列关于化学键的说法正确的是____。
① 含有金属元素的化合物一定是离子化合物
② 第IA族和第ⅦA族元素原子化合时,一定生成离子键
③ 由非金属元素形成的化合物一定不是离子化合物
④ 活泼金属与非金属化合时,能形成离子键
⑤ 离子键就是阴、阳离子间的相互引力
⑥离子化合物中可能含有非极性共价键
(3)写出下列物质的电子式:Mg(OH)2:____, N2:_______,NH4I:_______。
(4)用电子式表示下列化合物的形成过程:Na2S:_______;H2O:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①H2(g)+![]() O2(g)=H2O(g) ΔH1=akJ·mol1
O2(g)=H2O(g) ΔH1=akJ·mol1
②2H2(g)+O2(g)=2H2O(g) ΔH2=bkJ·mol1
③H2(g)+![]() O2(g)=H2O(l) ΔH3=ckJ·mol1
O2(g)=H2O(l) ΔH3=ckJ·mol1
④2H2(g)+O2(g)=2H2O(l) ΔH4=d kJ·mol1
下列关系式中正确的是
A.a<c<0B.b>d>0C.2a=b<0D.2c=d>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置可以验证非金属性的变化规律。

(1)仪器A的名称为________,干燥管D的作用是________________。
(2)已知在常温下,高锰酸钾和浓盐酸反应能生成氯气。实验室中现有药品Na2S溶液、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫的;装置A、B、C中所装药品分别为________、________、________,装置C中的实验现象为_________________,离子方程式为______。
(3)若要证明非金属性:S>C>Si,则A中加________、B中加Na2CO3、C中加________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:SO2(g)+ 1/2O2(g) ![]() SO3(g) ΔH=―98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为( )
SO3(g) ΔH=―98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为( )
A. 196.64kJB. 小于98.32kJ
C. 小于196.64kJD. 大于196.64kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环丙贝特(H)是一种降血脂药物,可明显降低极低密度和低密度脂蛋白水平,并升高高密度脂蛋白,通过改善胆固醇的分布,可减少CH和LDL在血管壁的沉积,还有溶解纤维蛋白和阻止血小板凝聚作用。如图是合成环丙贝特的一种新方法:
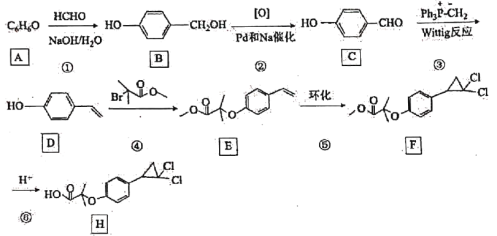
回答下列问题:
(1)B的化学名称为___________。
(2)F中非含氧官能团的名称为___________。
(3)反应①的反应类型为___________,反应④的化学方程式为_______________________。
(4)M为![]() 的同分异构体,能与NaHCO3溶液反应产生气体,则M的结构共有____种(不考虑立体异构);其中1HNMR中有3组峰,且峰面积之比为6:2:1的结构简式为___________。
的同分异构体,能与NaHCO3溶液反应产生气体,则M的结构共有____种(不考虑立体异构);其中1HNMR中有3组峰,且峰面积之比为6:2:1的结构简式为___________。
(5)利用Wittig反应,设计以环己烷为原料(其他试剂任选),制备![]() 的合成路线:____________________________________________。
的合成路线:____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com