
【题目】已知:①H2(g)+![]() O2(g)=H2O(g) ΔH1=akJ·mol1
O2(g)=H2O(g) ΔH1=akJ·mol1
②2H2(g)+O2(g)=2H2O(g) ΔH2=bkJ·mol1
③H2(g)+![]() O2(g)=H2O(l) ΔH3=ckJ·mol1
O2(g)=H2O(l) ΔH3=ckJ·mol1
④2H2(g)+O2(g)=2H2O(l) ΔH4=d kJ·mol1
下列关系式中正确的是
A.a<c<0B.b>d>0C.2a=b<0D.2c=d>0
【答案】C
【解析】
A选项,对于放热反应来说,ΔH为负,且反应放出的热量越多,ΔH越小。
①H2(g)+![]() O2(g)=H2O(g) ΔH1=akJ·mol1,
O2(g)=H2O(g) ΔH1=akJ·mol1,
③H2(g)+![]() O2(g)=H2O(l) ΔH3=ckJ·mol1
O2(g)=H2O(l) ΔH3=ckJ·mol1
相同物质的量的氢气生成液态水放出的热量越多,焓变ΔH越小,所以0 > a > c,故A错误;
B选项,②2H2(g)+O2(g)=2H2O(g) ΔH2=bkJ·mol1,④2H2(g)+O2(g)=2H2O(l) ΔH4=d kJ·mol1
相同物质的量的氢气生成液态水放出的热量越多,焓变ΔH越小;所以0 >b > d,故B错误;
C选项,①H2(g)+![]() O2(g)=H2O(g) ΔH1=akJ·mol1,
O2(g)=H2O(g) ΔH1=akJ·mol1,
②2H2(g)+O2(g)=2H2O(g) ΔH2=bkJ·mol1
②中物质的量是①中物质的量的2倍,反应放出的热量也是2倍,0 >2a = b,故C正确;
D选项,③H2(g)+![]() O2(g)=H2O(l) ΔH3=ckJ·mol1
O2(g)=H2O(l) ΔH3=ckJ·mol1
④2H2(g)+O2(g)=2H2O(l) ΔH4=d kJ·mol1
④中物质的量是③中物质的量的2倍,反应放出的热量也是2倍,0 >2c = b,故D错误;
综上所述,答案为C。


科目:高中化学 来源: 题型:
【题目】全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示。下列说法错误的是( )

A.放电过程中右槽溶液颜色逐渐由绿色变为紫色
B.放电过程中氢离子的作用之一是参与正极反应
C.充电过程中左槽溶液逐渐由蓝变黄
D.充电时若转移的电子数为3.01×1023个,左槽溶液中n(H+)的变化量为0.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有位于元素周期表前四周期的元素X、Y、Z、T、W、Q,其部分信息如下表:
X | 宇宙中含量最丰富的元素 |
Y | 植物生长所必需的三种营养元素中,电负性最大的 |
Z | 原子最外层电子数是其电子层数的3倍 |
Q | 其气态氢化物与其低价氧化物常温下能反应,生成该元素的单质 |
T | 最高正价与最低负价代数和为6,其单质能与强碱溶液反应制消毒液 |
W | 其+2价阳离子的价电子排布为3d9 |
请回答下列问题:
(1)W元素位于周期表的第___周期___族,W2+能与X、Y形成的简单分子结合生成一种深蓝色的离子,其离子符号为___。
(2)X与Z按原子个数比为1:1组合得到的一种物质甲,它能用于杀菌消毒,物质甲的电子式为___;Q与T也能按原子个数比为1:1组合,得到一种暗黄色的液体乙,其结构与甲相似,则乙中存在的化学键类型有___和___;乙遇水发生歧化反应,得到一种淡黄色的固体和两种具有刺激性气味的气体,该反应的化学反应方程式为___。
(3)元素Q的简单离子半径___元素T的简单离子半径(填“>”“<”或“=”);元素T能形成多种含氧酸:HTO、HTO2、HTO3、HTO4,其酸性由强到弱的顺序为___(用化学式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下将2 mol CO和2 mol H2O(g)充入2.0 L恒容绝热的密闭容器中,发生CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH,正反应速率和时间的关系如下图所示。下列说法正确的是( )
CO2(g)+H2(g) ΔH,正反应速率和时间的关系如下图所示。下列说法正确的是( )
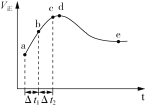
A.图中d点所示条件下,延长反应时间不能提高CO的转化率
B.反应器中的压强不变,说明反应已经达到平衡状态
C.Δt1=Δt2时,反应物的转化率:b~c段小于a~b段
D.e点CO的转化率为80%,则该温度下平衡常数为K=16
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌钡白ZnS·BaSO4是一种常用白色颜料,以重晶石(BaSO4)和焦炭粉为原料,在回转炉中强热制取可溶性硫化钡。硫化钡在净化后形成溶液,再与硫酸锌经过一系列过程最终制得锌钡白成品。
(1)回转炉中发生反应的化学方程式为___________________________。
(2)回转炉尾气中含有有毒气体,生产上通入一定量的水蒸气进行处理,水蒸气的作用是_____________________________。
(3)成品中S2-的含量可以用“碘量法”测得。称取m g样品,置于碘量瓶中,移取25.00 mL 0.1000 mol·L-1的I2-KI溶液于其中,并加入乙酸溶液,密闭,置暗处反应5 min,有单质硫析出。以淀粉溶液为指示剂,过量的I2用0.1000 mol·L-1Na2S2O3溶液滴定,反应式为I2+2S2O32-=2I-+S4O62-。测定时消耗Na2S2O3溶液体积V mL,滴定终点现象为__________,样品中S2-的含量为____________(写出表达式与计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同波长的光可以使有机化合物之间相互转化。如俘精酸酐类化合物甲、乙可以发生如下转化:
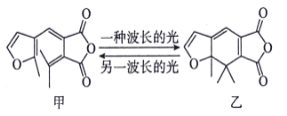
下列说法错误的是( )
A.甲与乙互为同分异构体
B.甲生成乙的反应类型为加成反应
C.甲、乙两种分子中均没有手性碳原子
D.1mol甲分子与足量NaOH溶液反应时消耗2mo1NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用纯净的CaCO3与l00mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积己折算为标准状况下的体积)。下列分析正确的是

A. EF段,用盐酸表示该反应的平均反应速率为0.4mol/(L·min)
B. OE段表示的平均速率最快
C. OE、EF、FG三段中,该反应用二氧化碳表示的平均反应速率之比为2:6:7
D. F点收集到的CO2的量最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1mol·L-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列判断正确的是( )
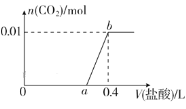
A.在0~a范围内,只发生中和反应
B.a=0.3
C.ab段发生反应的离子方程式为CO32-+2H+=CO2↑+H2O
D.原混合溶液中NaOH与Na2CO3的物质的量之比为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是物质间发生化学反应的颜色变化,下表选项物质对应正确的是
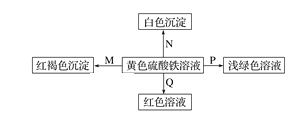
选项 | M | N | P | Q |
A | NH3·H2O | Ba(OH)2 | 铜 | KSCN |
B | Na | BaCl2 | FeO | KSCN |
C | NaOH | Ba(NO3)2 | 锌粉 | KSCN |
D | Na2O2 | MgCl2 | Fe | KSCN |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com