
【题目】已知有位于元素周期表前四周期的元素X、Y、Z、T、W、Q,其部分信息如下表:
X | 宇宙中含量最丰富的元素 |
Y | 植物生长所必需的三种营养元素中,电负性最大的 |
Z | 原子最外层电子数是其电子层数的3倍 |
Q | 其气态氢化物与其低价氧化物常温下能反应,生成该元素的单质 |
T | 最高正价与最低负价代数和为6,其单质能与强碱溶液反应制消毒液 |
W | 其+2价阳离子的价电子排布为3d9 |
请回答下列问题:
(1)W元素位于周期表的第___周期___族,W2+能与X、Y形成的简单分子结合生成一种深蓝色的离子,其离子符号为___。
(2)X与Z按原子个数比为1:1组合得到的一种物质甲,它能用于杀菌消毒,物质甲的电子式为___;Q与T也能按原子个数比为1:1组合,得到一种暗黄色的液体乙,其结构与甲相似,则乙中存在的化学键类型有___和___;乙遇水发生歧化反应,得到一种淡黄色的固体和两种具有刺激性气味的气体,该反应的化学反应方程式为___。
(3)元素Q的简单离子半径___元素T的简单离子半径(填“>”“<”或“=”);元素T能形成多种含氧酸:HTO、HTO2、HTO3、HTO4,其酸性由强到弱的顺序为___(用化学式表示)。
【答案】四 IB [Cu(NH3)4]2+ ![]() 极性键(或极性共价键) 非极性键(或非极性共价键) 2S2Cl2+2H2O=3S↓+SO2↑+4HC1 > HClO4>HClO3>HClO2>HClO
极性键(或极性共价键) 非极性键(或非极性共价键) 2S2Cl2+2H2O=3S↓+SO2↑+4HC1 > HClO4>HClO3>HClO2>HClO
【解析】
X为宇宙中含量最丰富的元素,则X为H元素,Y为植物生长所必需的三种营养元素为N、P、K,电负性最大的为N,则Y为N元素,Z原子最外层电子数是其电子层数的3倍,则Z为O元素,Q的其气态氢化物与其低价氧化物常温下能反应,生成该元素的单质,则Q为S元素,T最高正价与最低负价代数和为6,其单质能与强碱溶液反应制消毒液,则T为Cl元素,W的+2价阳离子的价电子排布为3d9,其原子的价层电子排布为3d104s1,W为Cu元素,据此分析结合元素性质解答。
(1)W为Cu元素,Y为N元素,X为H元素,Cu位于周期表的第四周期IB族,Cu2+能与H、N形成的简单分子结合生成一种深蓝色的离子为四氨合铜离子,其离子符号为[Cu(NH3)4]2+;
(2)X为H元素,Z为O元素,X与Z按原子个数比为1:1组合得到的一种物质甲为H2O2,它能用于杀菌消毒,H2O2的电子式为![]() ;Q为S元素,T为Cl元素,也能按原子个数比为1:1组合,得到一种暗黄色的液体乙为S2Cl2,其结构与H2O2相似,则乙中存在的化学键类型有极性键(或极性共价键)和非极性键(或非极性共价键);S2Cl2遇水发生歧化反应,得到一种淡黄色的固体为S单质和两种具有刺激性气味的气体为Cl2和SO2,该反应的化学反应方程式为2S2Cl2+2H2O=3S↓+SO2↑+4HC1;
;Q为S元素,T为Cl元素,也能按原子个数比为1:1组合,得到一种暗黄色的液体乙为S2Cl2,其结构与H2O2相似,则乙中存在的化学键类型有极性键(或极性共价键)和非极性键(或非极性共价键);S2Cl2遇水发生歧化反应,得到一种淡黄色的固体为S单质和两种具有刺激性气味的气体为Cl2和SO2,该反应的化学反应方程式为2S2Cl2+2H2O=3S↓+SO2↑+4HC1;
(3)Q为S元素,T为Cl元素,二者同周期,其简单离子的核外电子排布结构相同,核电荷数越大,半径越小,则Q元素简单离子半径>T的简单离子半径;元素Cl能形成多种含氧酸:HClO、HClO2、HClO3、HClO4,非羟基氧原子数目越多,酸性越强,则其酸性由强到弱的顺序为HClO4>HClO3>HClO2>HClO。


科目:高中化学 来源: 题型:
【题目】现有易溶强电解质的混合溶液10L,其中可能含存![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的几种,向其中通入
中的几种,向其中通入![]() 气体,产生沉淀的量与通入
气体,产生沉淀的量与通入![]() 的量之间的关系如图所示,下列说法正确的是( )
的量之间的关系如图所示,下列说法正确的是( )

A.该溶液中能确定存在的离子是![]() 、
、![]() 、
、![]()
B.肯定不存在的离子是![]() 、
、![]()
C.若不能确定的离子中至少还存在一种阳离子,则该离子的最小浓度为0.2mol/L
D.OA段反应的离子方程式:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二元弱酸(简写为H2B)溶液,按下式发生一级和二级电离:
H2B![]() H++HB-
H++HB-
HB-![]() H++B2-
H++B2-
已知相同浓度时的电离度a(H2B)>>a(HB-),现有下列四种溶液:
①0.01molL-1的H2B溶液
②0.01molL-1的NaHB溶液
③0.02molL-1的HCl溶液与0.04molL-1的NaHB溶液等体积混合后的溶液
④0.02molLL-1的NaOH溶液与0.02molL-1的NaHB溶液等体积混合后的溶液
下列说法错误的是( )
A.溶液④一定显碱性B.c(H2B)最大的是③
C.c(B2-)最小的是①D.c(H+)最大的是③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学在日常生活中用途广泛,如图①是镁、次氯酸钠燃料电池的示意图,电池总反应式为:Mg+ClO-+H2O=Cl-+Mg(OH)2↓。如图②是电解法除去工业废水中的Cr2O72-,下列说法正确的是( )
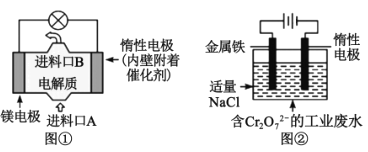
A.图①中镁电极发生的反应是:ClO-+H2O+2e-=Cl-+2OH-
B.图②最终得到Fe(OH)3和Cr(OH)3,则阳极上的电极反应式为:Fe-3e-=Fe3+
C.图②中每转移0.2mol电子,阴极逸出2.24LH2
D.若图①中7.2gMg溶解产生的电量用于图②废水处理,理论得到Fe(OH)3的物质的量为0.3mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】膜技术原理在化工生产中有着广泛的应用。有人设想利用电化学原理制备少量硫酸和绿色硝化剂N205,装置图如下,下列说法正确的是( )

A. 图中B装置是原电池
B. N2O5在B池的c极区生成,其电极反应式为N2O4+2HNO3-2e-=2N2O5+2H+
C. A装置中通入O2一极的电极反应式为O2+2H2O+4e-=4OH-
D. 若A装置中通入SO2的速率为2.24Lmin-1(标准状况),为稳定持续生产,硫酸溶液的浓度应维持不变,则左侧水的流入速率应为14.6mLmin-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼酸在生活中应用广泛,H3BO3可以通过电解NaB(OH)4溶液的方法制备,其工作原理如图,a、c为阳离子交换膜,且H+可B(OH)4-与反应生成H3BO3,下列叙述错误的是( )
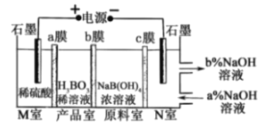
A. M室发生的电极反应式为:2H2O-4e-=O2↑+4H+
B. N室中:a%<b%
C. b膜为阴离子交换膜,产品室发生反应的化学原理为强酸制弱酸
D. 理论上每生成1mol产品,阴极室可生成标准状况下5.6L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.NaClO(aq)![]() HClO(aq)
HClO(aq)![]() Cl2(g)
Cl2(g)
B.Fe3O4(s)![]() Fe(s)
Fe(s)![]() Fe(NO3)3(aq)
Fe(NO3)3(aq)
C.Cu(s)![]() Cu2O(s)
Cu2O(s)![]() CuSO4(aq)
CuSO4(aq)
D.S(s)![]() SO2(g)
SO2(g)![]() BaSO3(s)
BaSO3(s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①H2(g)+![]() O2(g)=H2O(g) ΔH1=akJ·mol1
O2(g)=H2O(g) ΔH1=akJ·mol1
②2H2(g)+O2(g)=2H2O(g) ΔH2=bkJ·mol1
③H2(g)+![]() O2(g)=H2O(l) ΔH3=ckJ·mol1
O2(g)=H2O(l) ΔH3=ckJ·mol1
④2H2(g)+O2(g)=2H2O(l) ΔH4=d kJ·mol1
下列关系式中正确的是
A.a<c<0B.b>d>0C.2a=b<0D.2c=d>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钇钡铜氧、汞钡铜氧、汞钡钙铜氧等都是常见的高温超导体。回答下列问题:
(1)钇(39Y)是一种重要的稀土金属,基态Y原子的价电子排布式为______。下列科学家中,在稀土化学领域做出重要贡献的是_________(填标号)。
a.侯德榜 b.屠呦呦 c.徐光宪
(2)BaCO3可用于制备上述高温超导体,其3种组成元素中,第一电离能最大的是______(填元素符号),CO32-的空间构型为________,其中碳原子的杂化方式为________________。
(3)汞钡铜氧晶体的晶胞如下图A所示,通过掺杂Ca2+获得的具有更高临界温度的超导材料如图B所示。
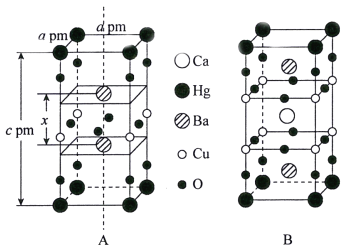
汞钡铜氧晶体的密度为______g·cm-3(设NA为阿伏加德罗常数的值)。图A晶胞中钡离子的分数坐标为(![]() )和_________。掺杂Ca2+所得超导材料的化学式为_________。
)和_________。掺杂Ca2+所得超导材料的化学式为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com