
【题目】化合物Y是一种药物中间体,可由X制得:
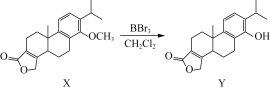
下列有关化合物X、Y的说法正确的是( )
A.Y分子中五元环上的4个碳原子一定共平面
B.1 mol X最多能与2 mol Br2反应
C.用FeCl3溶液可鉴别化合物X和Y
D.X、Y在酸性条件下的水解产物均能发生氧化反应、加成反应、消去反应
【答案】AC
【解析】
A. 在Y分子中五元环上有碳碳双键,由于乙烯分子是平面分子,与碳碳双键连接的2个C原子可看作是取代乙烯分子中2个H原子的位置,一定在乙烯分子的平面上,所以其中的4个碳原子一定共平面,A正确;
B. X分子中含有1个碳碳双键能够与Br2发生加成反应,羰基、苯环不能与溴反应,所以1 mol X最多能与1 mol Br2反应,B错误;
C. X分子中无酚羟基,Y分子中含有酚羟基,遇FeCl3溶液会显紫色,因此可用FeCl3溶液可鉴别化合物X和Y,C正确;
D. X、Y在酸性条件下的水解产物中含有1个醇羟基,由于羟基连接的C原子邻位C原子上没有H原子,因此不能发生消去反应,D错误;
故合理选项是AC。


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】常温时,在H2CO3溶液中逐滴加入NaOH溶液,溶液中H2CO3、HCO3-和CO32-的物种分布分数![]() (X)=
(X)=![]() 与pH的关系如图所示:
与pH的关系如图所示:

下列说法正确的是
A. 反应HCO3-![]() H++CO32-的lgK=-6.4
H++CO32-的lgK=-6.4
B. pH═8的溶液中:c(Na+)>c(HCO3-)
C. NaHCO3溶液中滴入少量盐酸至溶液显中性:c(Na+)═c(Cl-)
D. 向pH=6.4的溶液中滴加NaOH溶液至pH=8,主要发生的离子反应:HCO3-+OH-═CO32-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代技术可利用电解法制H2O2并用产生的H2O2处理废氨水,其装置如图所示。下列说法正确的是( )
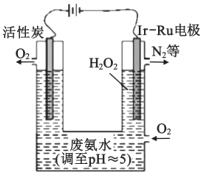
A.该过程的总反应为:3H2O2+8H++4NH3H2O=8H2O+N2↑+2NH4+
B.Ir-Ru惰性电极有吸附O2的作用,该电极上的反应为:O2+2H++2e-=H2O2
C.理论上电路中每转移6mol电子,最多可以处理NH3H2O的物质的量为1mol
D.为了不影响H2O2的产量,需要向废氨水中加入适量硝酸调节溶液的pH约为5,则所得的废氨水溶液中c(NH4+)>c(NO3-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以废铜屑(含少量Fe、不溶性杂质)为原料制取CuSO4·5H2O晶体和[Cu(NH3)4]SO4·H2O晶体,其实验流程如下:
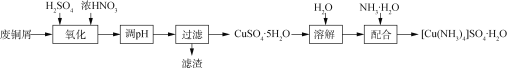
(1)氧化时先加入一定量3 mol/L H2SO4,再调节浓硝酸的用量至![]() 为2.0左右时,铜粉和浓硝酸完全反应,主要反应的化学方程式为_______。
为2.0左右时,铜粉和浓硝酸完全反应,主要反应的化学方程式为_______。
硝酸过量对产品的影响为________________________________。
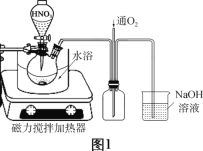
(2)废铜屑的氧化在如图1所示的装置中进行。从长导管中通入氧气的作用是___________。保持试剂的用量不变,实验中提高Cu转化率的操作有____________(写一种)。
(3)调节溶液pH应在3.5~4.5范围的原因是______________________。
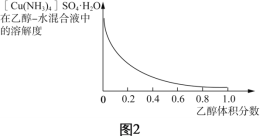
(4)已知:[Cu(NH3)4]2+![]() Cu2++4NH3;CuSO4、(NH4)2SO4难溶于乙醇。结合图2,[Cu(NH3)4]SO4·H2O在乙醇水混合液中的溶解度随乙醇浓度变化曲线,补充完整由加足量氨水后所得的[Cu(NH3)4]SO4溶液制备[Cu(NH3)4]SO4·H2O晶体的实验方案:______________ (实验中必须使用的试剂和仪器:无水乙醇、乙醇-水混合液、BaCl2溶液、真空干燥箱)。
Cu2++4NH3;CuSO4、(NH4)2SO4难溶于乙醇。结合图2,[Cu(NH3)4]SO4·H2O在乙醇水混合液中的溶解度随乙醇浓度变化曲线,补充完整由加足量氨水后所得的[Cu(NH3)4]SO4溶液制备[Cu(NH3)4]SO4·H2O晶体的实验方案:______________ (实验中必须使用的试剂和仪器:无水乙醇、乙醇-水混合液、BaCl2溶液、真空干燥箱)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.过氧化钠投入水中:Na2O2+2H2O=O2↑+2OH-+2Na+
B.用FeCl3腐蚀印刷电路板:Cu+Fe3+=Cu2++Fe2+
C.在碳酸氢钙溶液中加入少量苛性钠溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O
D.Fe与水蒸气反应:2Fe+3H2O(g)![]() Fe2O3+3H2
Fe2O3+3H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)某种粒子有1个原子核,核中有17个质子,20个中子,核外有18个电子,该粒子的化学符号是__。
(2)下列关于化学键的说法正确的是____。
① 含有金属元素的化合物一定是离子化合物
② 第IA族和第ⅦA族元素原子化合时,一定生成离子键
③ 由非金属元素形成的化合物一定不是离子化合物
④ 活泼金属与非金属化合时,能形成离子键
⑤ 离子键就是阴、阳离子间的相互引力
⑥离子化合物中可能含有非极性共价键
(3)写出下列物质的电子式:Mg(OH)2:____, N2:_______,NH4I:_______。
(4)用电子式表示下列化合物的形成过程:Na2S:_______;H2O:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mL FeI2溶液中逐渐通入C12,其中n(I2)、n(Fe3+)随通入n(C12)的变化如图所示,下列说法不正确的是

A. 氧化性强弱:I2<Fe3+
B. n(Cl2)=0.12mol时,溶液中的离子主要有Fe2+、Fe3+、Clˉ
C. 由图可知,该FeI2溶液的浓度为1mol· L-l
D. n(C12):n(FeI2)=1:2时,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D同族,C离子和B离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成的化合物是日常生活中的常用调味品。回答下列问题:
(1)五种元素中,原子半径最大的是________,非金属性最强的是________(填元素符号)。
(2)由A分别和B、D、E所形成的共价型化合物中,热稳定性最差的是__________(用化学式表示)。
(3)A、B、E形成的离子化合物电子式为____________,其中存在的化学键类型为____________。
(4)D最高价氧化物的水化物的化学式为________________。
(5)单质D在充足的单质E中燃烧,反应的化学方程式为__________________;D在不充足的E中燃烧,生成的主要产物的化学式为__________。
(6)单质E与水反应的离子方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列有关叙述正确的是
A.用浓盐酸分别和MnO2、KClO3反应制备1 mol氯气,转移的电子数均为2NA
B.0.1 mol·L-1 NaF溶液中所含F-的数目小于0.1NA
C.用1 L 1 mol·L-1 FeCl3溶液充分反应制备氢氧化铁胶体,该体系中含氢氧化铁胶体粒子数目为1NA
D.标准状况下,4.48 L CO2和N2O的混合气体中含有的电子数为4.4NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com