
【题目】元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是___。
a.原子半径和离子半径均减小 b.金属性减弱,非金属性增强
c.氧化物对应的水化物碱性减弱,酸性增强 d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为___,氧化性最弱的简单阳离子是___。
(3)已知:
化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是___;制铝时,电解Al2O3而不电解AlCl3的原因是___。
(4)晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:Si(粗)![]() SiCl4
SiCl4![]() SiCl4(纯)
SiCl4(纯)![]() Si(纯)
Si(纯)
写出SiCl4的电子式:___;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,写出该反应的热化学方程式:____。
(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是____。
a.NH3 b.HI c.SO2 d.CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1。写出该反应的化学方程式:____。
【答案】b 氩 Na+ MgO的熔点高,熔融时消耗更多能量,增加生产成本 氯化铝是共价化合物,熔融态氯化铝难导电 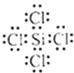 SiCl4(g)+2H2(g)=Si(s)+4HCl(g)
SiCl4(g)+2H2(g)=Si(s)+4HCl(g) ![]() =+0.025akJmol-1 b 4KClO3
=+0.025akJmol-1 b 4KClO3![]() KCl+3KClO4
KCl+3KClO4
【解析】
(1)a、同一周期,随着原子序数的增大,原子半径逐渐减小,简单离子半径先减小后增大再减小;
b、同一周期元素,随着原子序数的增大,元素的金属性逐渐减弱,非金属性逐渐增强;
c、元素的金属性越强,其最高价氧化物的水化物碱性越强,元素的非金属性越强,其最高价氧化物的水化物酸性越强;
d、同一周期元素,其单质的熔点先增大后减小;
(2)第三周期中,次外层电子数为8,原子最外层电子书与次外层电子数相同,则该元素为氩;第三周期中简单阳离子为钠离子、镁离子和铝离子,金属的还原性越强,对应离子的氧化性越弱;
(3)氧化镁熔点远远大于氯化镁,电解MgO冶炼Mg浪费能源;氯化铝是共价化合物,熔融状态下不导电;
(4)四氯化硅为共价化合物,氯原子和硅原子都达到8个电子,每生成1.12kg纯硅需吸收akJ热量,结合物质的量与反应放出的热量成正比计算;
(5)浓硫酸具有强氧化性、酸性,P2O5是非氧化性干燥剂;
(6)根据题干信息判断该无氧酸盐为氯化钾,再根据化合价变化判断另一种无氧酸盐名称,最后根据化合价升降相等配平即可。
(1)a、第三周期中,随着原子序数的递增,原子半径逐渐减小,而离子半径需要根据阴阳离子进行讨论,阳离子只有2个电子层,随着核电荷数在增大,半径逐渐减小,而阴离子有3个电子层,随着核电荷数的增加逐渐减小,但是阴离子半径整体大于阳离子半径,从阳离子到阴离子,半径在增大,故a错误;
b、同一周期中,随着核电荷数的递增,元素的金属性逐渐减弱,非金属性逐渐增强,故b正确;
c、元素的金属性越强,其最高价氧化物的水化物碱性越强,元素的非金属性越强,其最高价氧化物的水化物酸性越强,所以其最高价氧化物的水化物碱性减弱、酸性增强,故c错误;
d、同一周期元素,其单质的熔点先增大后减小,Si的熔点最高,故d错误;
故答案为:b;
(2)原子最外层电子书与次外层电子数相同,而第三周期中次外层电子为8,该元素原子结构示意图为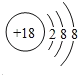 ,则该元素为氩;金属的还原性越强,对应离子的氧化性越弱,所以第三周期中氧化性最弱的为Na+,
,则该元素为氩;金属的还原性越强,对应离子的氧化性越弱,所以第三周期中氧化性最弱的为Na+,
故答案为:氩;Na+;
(3)氧化镁熔点远远大于氯化镁,电解MgO冶炼Mg浪费能源,所以用熔融态氯化镁冶炼镁;
氯化铝是共价化合物,熔融状态下以分子存在,所以不导电,则用熔融氧化铝冶炼Al,
故答案为:MgO的熔点高,熔融时消耗更多能量,增加生产成本;氯化铝是共价化合物,熔融态氯化铝难导电;
(4)四氯化硅为共价化合物,氯原子和硅原子都达到8个电子,四氯化硅的电子式为 ,每生成1.12kg纯硅需吸收akJ热量,则生成1mol纯硅吸收的热量为
,每生成1.12kg纯硅需吸收akJ热量,则生成1mol纯硅吸收的热量为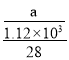 =0.025akJ,所以热化学方程式为:SiCl4(g)+2H2(g)=Si(s)+4HCl(g)
=0.025akJ,所以热化学方程式为:SiCl4(g)+2H2(g)=Si(s)+4HCl(g) ![]() =+0.025akJmol-1,
=+0.025akJmol-1,
故答案为: ;SiCl4(g)+2H2(g)=Si(s)+4HCl(g)
;SiCl4(g)+2H2(g)=Si(s)+4HCl(g) ![]() =+0.025akJmol-1;
=+0.025akJmol-1;
(5)浓硫酸具有强氧化性、酸性,不能干燥具有还原性、碱性的气体,
a、NH3为碱性气体,不能用浓硫酸和五氧化二磷干燥,可用碱石灰干燥,故错误;
b、HI为还原性气体,不能利用浓硫酸干燥,可以利用P2O5干燥,故正确;
c、SO2为酸性气体,可以用浓硫酸、五氧化二磷或无水氯化钙干燥,故错误;
d、CO2为酸性气体,可以用浓硫酸、五氧化二磷或无水氯化钙干燥,故D错误;
故答案为:b;
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1,则该无氧酸为KCl,KCl中氯元素化合价为-1,说明氯酸钾中氯元素化合价降低,则另一种含氧酸盐中氯元素化合价会升高,由于氯酸钾中氯元素化合价为+5,则氯元素化合价升高只能被氧化成高氯酸钾,根据氧化还原反应中化合价升降相等配平该反应为:4KClO3![]() KCl+3KClO4,
KCl+3KClO4,
故答案为:4KClO3![]() KCl+3KClO4。
KCl+3KClO4。


科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关,下列叙述正确的是( )
A. 淀粉、油脂和蛋白质都是天然高分子化合物
B. 葡萄糖注射液不能产生丁达尔效应现象,不属于胶体
C. 14C可用于文物年代的鉴定,14C与12C互为同素异形体
D. 从海水中可以得到NaCl,电解饱和NaCl溶液可以得到金属Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表各组物质之间通过一步反应不可以实现如下图所示转化关系的是

选项 | X | Y | Z | 箭头上所标数字的反应条件 |
A | SiO2 | Na2SiO3 | H2SiO3 | ①与Na2CO3熔融 |
B | NaCl | NaHCO3 | Na2CO3 | ②加热 |
C | N2 | NO2 | HNO3 | ③加热 |
D | C | CO | CO2 | ④灼热炭粉 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Prolitane 是一种抗抑郁药物,以芳香烃 A 为原料的合成路线如下:

请回答以下问题:
(1)A 的结构简式为_____。D 的化学名称为_____,
(2)E 的官能团名称分别为_____和_____。
(3)H→Prolitane 的反应类型为_____。
(4)F→G 的化学方程式为_____。
(5)C 的同分异构体中能同时满足下列条件的共有_____种(不含立体异构);
①属于芳香化合物
②能发生银镜反应
③能发生水解反应
其中核磁共振氢谱显示为 4 组峰,其峰面积比为 3∶2∶2∶1,写出符合要求的该同分异构体的结构简式_____________。
(6)参照 Prolitane 的合成路线,设计一条由苯和乙醇为原料制备苯甲酸乙酯的合成路线(其他无机试剂和溶剂任选):__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是()
A.![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
B.由水电离的c(H+)=1×10-14mol/L的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
C.![]()
![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
D.![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3-对甲苯丙烯酸甲酯(E)是一种用于合成抗血栓药的中间体,其合成路线如图:

已知:HCHO+CH3CHO![]() CH2=CHCHO+H2O
CH2=CHCHO+H2O
(1)A的名称是___,遇FeCl3溶液显紫色且苯环上有两个取代基的A的同分异构体有___种。B的结构简式___,D中含氧官能团的名称为___。
(2)试剂C可选用下列中的___。
a.溴水 b.银氨溶液 c.酸性KMnO4溶液 d.新制Cu(OH)2悬浊液
(3) 是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为___。
是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为___。
(4)E在一定条件下可以生成高聚物F,F的结构简式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关从海带中提取碘的实验原理和装置能达到实验目的的是

A. 用装置甲灼烧碎海带
B. 用装置乙过滤海带灰的浸泡液
C. 用装置丙制备用于氧化浸泡液中I的Cl2
D. 用装置丁吸收氧化浸泡液中I后的Cl2尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲乙两装置的电极材料和电解质溶液均相同,则两装置中相同的是( )
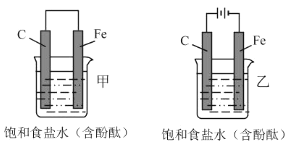
A.在碳电极上所发生的电极反应B.在铁电极附近的溶液先变红色
C.铁极与导线连接处的电流方向D.碳电极既不会变大也不会减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫、氯的单质和化合物应用广泛。
(1)将硫铁矿和焦炭按物质的量之比为3∶2混合放在炼硫炉中,通入适量空气,发生下列燃烧反应:
FeS2+C+O2→Fe3O4+CO+S。
配平上述化学反应方程式:______________________________。生成3 mol硫,被氧化物质的物质的量为__________________。
(2)盐酸是应用广泛的酸之一,它具有
a.酸性;b.氧化性;c.还原性;d.挥发性。
请回答下列问题:
①浓盐酸长时间露置在空气中,溶液的质量减轻,盐酸表现了________(填序号)。
②实验室用稀盐酸和锌粒反应制取氢气,盐酸表现了________(填序号),反应的离子方程式为_____________________________________________________________________。
③用盐酸除去铁表面的铁锈,盐酸表现了______(填序号),反应的离子方程式为__________________________________________________________________。
④实验室常用KMnO4和浓盐酸反应制取Cl2,反应的化学方程式为2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。被还原的元素是______,还原剂是______,氧化产物是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com