
【题目】如图所示,甲乙两装置的电极材料和电解质溶液均相同,则两装置中相同的是( )
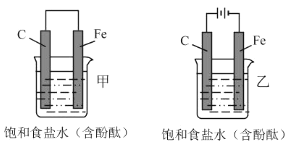
A.在碳电极上所发生的电极反应B.在铁电极附近的溶液先变红色
C.铁极与导线连接处的电流方向D.碳电极既不会变大也不会减小
【答案】D
【解析】
A.甲中形成原电池,石墨电极为正极,氧气得电子发生还原反应生成氢氧根离子,乙中形成电解池,石墨是阳极,氯离子放电生成氯气,电极反应不同,故A错误;
B.甲中形成原电池,石墨电极为正极,氧气得电子发生还原反应生成氢氧根离子,则石墨电极附近的溶液先变红色,乙中形成电解池,铁是阴极,氢离子得电子生成氢气,同时生成氢氧根离子,则在铁电极附近的溶液先变红色,故B错误;
C.甲中形成原电池,电流由正极石墨经导线流向铁,乙中形成电解池,电流由铁流向负极,则铁极与导线连接处的电流方向不同,故C错误;
D.甲乙装置,碳电极都没有参加反应,甲中石墨电极为正极,氧气得电子发生还原反应生成氢氧根离子,乙中石墨是阳极,氯离子放电生成氯气,则碳电极既不会变大也不会减小,故D正确;
故选:D。


科目:高中化学 来源: 题型:
【题目】在一容积可变的密闭容器中,充入一定量的H2和I2(g)发生反应:I2(g)+H2(g)![]() 2HI(g) ΔH<0。t2时刻开始只改变一个条件,反应速率与反应进程的曲线关系如图所示。下列说法错误的是
2HI(g) ΔH<0。t2时刻开始只改变一个条件,反应速率与反应进程的曲线关系如图所示。下列说法错误的是
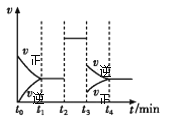
A.t0—t2时段,H2的浓度不变即体系达到平衡
B.t2时,改变的条件只有加入催化剂才能实现
C.在t4所处的平衡体系中,再加入H2,I2(g)的转化率增大
D.HI的体积分数最高的时段是t1—t2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是___。
a.原子半径和离子半径均减小 b.金属性减弱,非金属性增强
c.氧化物对应的水化物碱性减弱,酸性增强 d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为___,氧化性最弱的简单阳离子是___。
(3)已知:
化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是___;制铝时,电解Al2O3而不电解AlCl3的原因是___。
(4)晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:Si(粗)![]() SiCl4
SiCl4![]() SiCl4(纯)
SiCl4(纯)![]() Si(纯)
Si(纯)
写出SiCl4的电子式:___;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,写出该反应的热化学方程式:____。
(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是____。
a.NH3 b.HI c.SO2 d.CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1。写出该反应的化学方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是反应CO(g)+2H2(g) = CH3OH(g)进行过程中的能量变化曲线。下列相关说法正确的是

A. 该反应是吸热反应
B. 使用催化剂后反应热减小
C. 热化学方程式为CO(g)+2H2(g) = CH3OH(g)△H=-510 kJ·mol-1
D. 曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一固定容积的密闭容器中,可逆反应: H2(g) + I2(g) ![]() 2HI (g)达到平衡的标志是
2HI (g)达到平衡的标志是
A. H2、I2、HI的分子数之比为1∶1∶2
B. 混合气体的密度保持不变
C. 单位时间生成n mol H2,同时消耗2n mol HI
D. 混合气体的颜色不再发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有广泛的应用前景。工业上采用下列两种反应合成甲醇:
反应I:CO(g)+2H2(g)![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应II:CO2(g)+3H2(g)![]() CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
(1)下表所列数据是反应I在不同温度下的化学平衡常数(K)。
温度 | 250℃ | 300℃ | 350℃ |
K | 2.04 | 0.25 | 0.012 |
①由表中数据判断ΔH1 _________0 (填“>”、“=”或“<”)。
②某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,5 min后达到平衡,测得c(CO)=0.2 mol/L,则用H2表示的5min内该反应的反应速率v(H2)=_______mol·L-1·min-1,该温度下此反应的平衡常数为___________,此时的温度为________(从上表中选择)。
(2)一定条件下,将1 mol CO与 3 mol H2的混合气体在催化剂作用下能自发反应生成甲醇。若容器容积不变,下列措施可提高CO转化率的是________。
A.升高温度 B.将CH3OH(g)从体系中分离
C.恒容条件下充入He D.再充入适量的 H2
(3)为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
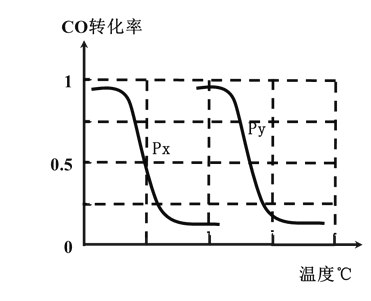
实验编号 | 温度(℃) | n(CO)/n(H2) | 压强(MPa) |
1 | a | 1/2 | 0.2 |
2 | 200 | b | 5 |
3 | 350 | 1/2 | 0.2 |
A.则上表中剩余的实验条件数据:a=________、b=_______。
B.根据反应I的特点,左下图是在压强分别为0.2MPa和5MPa下CO的转化率随温度变化的曲线图,请指明图中的压强Py=______MPa。
(4)上述反应中需要用到H2做反应物,以甲烷为原料制取氢气是常用的制氢方法。已知:
①CH4(g) + H2O(g) = CO(g) + 3H2(g) ΔH = +206.2 kJ·mol-1
②CH4(g) + CO2(g) = 2CO(g) + 2H2(g) ΔH = +247.4 kJ·mol-1
则CH4和H2O(g)反应生成CO2和H2的热化学方程式为:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关盐类水解的说法中,不正确的是( )。
A. 盐类的水解过程破坏了纯水的电离平衡
B. 盐类的水解是酸碱中和反应的逆反应
C. 盐类水解后的溶液不一定显中性
D. ![]() 溶液中,
溶液中, ![]() 是
是![]() 的两倍
的两倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学电池在通讯、交通及日常生活中有着广泛的应用.目前常用的镍(Ni)镉(Cd)电池,其电池总反应可以表示为:Cd+2NiO(OH)+2H2O![]() 2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法正确的是
2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法正确的是
①以上反应是可逆反应 ②以上反应不是可逆反应
③Cd为电池的正极 ④放电时化学能转变为电能.
A.①③B.②④C.①④D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,与盐类水解有关的是( )
①明矾可以做净水剂;
②实验室配制FeCl3溶液时,将FeCl3溶于少量的浓盐酸再加水稀释;
③用NaHCO3和Al2(SO4)3两种溶液可作泡沫灭火剂;
④在NH4Cl溶液中加入金属镁会产生氢气;
⑤草木灰与铵态氮肥不能混合施用;
⑥比较NH4Cl和Na2S等某些盐溶液的酸碱性.
A. ①④⑥ B. ②③⑤ C. ③④⑤ D. ①②③④⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com