
����Ŀ���״���һ�ֿ�������Դ�����й㷺��Ӧ��ǰ������ҵ�ϲ����������ַ�Ӧ�ϳɼ״���
��ӦI��CO(g)��2H2(g)![]() CH3OH(g) ��H1
CH3OH(g) ��H1
��ӦII��CO2(g)��3H2(g)![]() CH3OH(g) + H2O(g) ��H2
CH3OH(g) + H2O(g) ��H2
��1���±����������Ƿ�ӦI�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ����K����
�¶� | 250�� | 300�� | 350�� |
K | 2.04 | 0.25 | 0.012 |
���ɱ��������жϦ�H1 _________0 �����������������������
��ij�¶��£���2 mol CO��6 mol H2����2 L���ܱ������У�5 min��ﵽƽ�⣬���c(CO)��0.2 mol��L������H2��ʾ��5min�ڸ÷�Ӧ�ķ�Ӧ����v(H2)=_______mol��L-1��min-1�����¶��´˷�Ӧ��ƽ�ⳣ��Ϊ___________����ʱ���¶�Ϊ________�����ϱ���ѡ��
��2��һ�������£���1 mol CO�� 3 mol H2�Ļ�������ڴ������������Է���Ӧ���ɼ״����������ݻ����䣬���д�ʩ�����COת���ʵ���________��
A�������¶� B����CH3OH��g������ϵ�з���
C�����������³���He D���ٳ��������� H2
��3��Ϊ��Ѱ�Һϳɼ״����¶Ⱥ�ѹǿ������������ijͬѧ���������ʵ�飬����ʵ�������Ѿ���������ʵ����Ʊ��С�
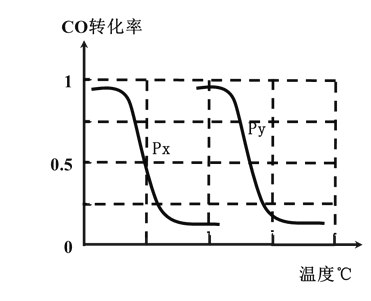
ʵ���� | �¶ȣ��棩 | n(CO)/n(H2) | ѹǿ��MPa�� |
1 | a | 1/2 | 0.2 |
2 | 200 | b | 5 |
3 | 350 | 1/2 | 0.2 |
A�����ϱ���ʣ���ʵ���������ݣ�a=________��b=_______��
B�����ݷ�ӦI���ص㣬����ͼ����ѹǿ�ֱ�Ϊ0.2MPa��5MPa��CO��ת�������¶ȱ仯������ͼ����ָ��ͼ�е�ѹǿPy=______MPa��
��4��������Ӧ����Ҫ�õ�H2����Ӧ��Լ���Ϊԭ����ȡ�����dz��õ����ⷽ������֪��
��CH4(g) + H2O(g) = CO(g) + 3H2(g) ��H = +206.2 kJ��mol-1
��CH4(g) + CO2(g) = 2CO(g) + 2H2(g) ��H = +247.4 kJ��mol-1
��CH4��H2O(g)��Ӧ����CO2��H2���Ȼ�ѧ����ʽΪ��__________________________��
���𰸡�< 0.32 2.04 250�� BD 200 1/2 5 CH4(g) + 2H2O(g) = CO2(g) + 4H2(g) ��H = +165 kJ��mol-1
��������
��1�����ɱ������ݿ�֪���¶�Խ��ƽ�ⳣ��ԽС��˵�������¶�ƽ�����淴Ӧ�����ƶ�������ӦΪ���ȷ�Ӧ��
�ڸ���![]() ���м��㣻����
���м��㣻����![]() ����ƽ�ⳣ����
����ƽ�ⳣ����
��2�������ݻ����䣬����COת���ʣ�ƽ��������Ӧ�ƶ����������������ƽ���Ӱ�������
��3��A. ��ȡ���Ʊ�������̽���ϳɼ״����¶Ⱥ�ѹǿ�������������ݴ��ж�a��b��ֵ��
B. ���ݶ�һ���ԭ���¶�ͬ���ٱȽ�ѹǿ��������ֱx��ĸ����ߣ��Ƚ�ƽ��ʱCO��ת���ʣ��ɴ��жϡ�
��4�����ݸ�˹���ɼ��㣻
���ɱ������ݿ�֪���¶�Խ��ƽ�ⳣ��ԽС��˵�������¶�ƽ�����淴Ӧ�����ƶ�������ӦΪ���ȷ�Ӧ������H1��0��
�ʴ�Ϊ��<��
�ڳ�ʼCO��Ũ��Ϊ2mol/2L=1mol/L��![]() ��
��
![]() ��ƽ�ⳣ��
��ƽ�ⳣ��![]() ��������ʽ��
��������ʽ��

![]() ��ƽ�ⳣ��ֻ���¶��йأ��¶���ͬƽ�ⳣ����ͬ���Աȱ������ݿ�֪��ʱ�¶�Ϊ250����
��ƽ�ⳣ��ֻ���¶��йأ��¶���ͬƽ�ⳣ����ͬ���Աȱ������ݿ�֪��ʱ�¶�Ϊ250����
�ʴ�Ϊ��0.32��2.04��250����
��2����A���÷�ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�������ȷ����ƶ��������淴Ӧ�����ƶ����״��IJ��ʽ��ͣ���A����
B����CH3OH��g������ϵ�з��룬�����Ũ�Ƚ��ͣ�ƽ��������Ӧ�ƶ����״��IJ������ӣ���B����
C������He��ʹ��ϵ��ѹǿ���������ݻ����䣬��Ӧ���������Ũ�Ȳ��䣬ƽ�ⲻ�ƶ����״��IJ��ʲ��䣬��C����
D���ٳ���molH2��ƽ��������Ӧ�����ƶ����״��IJ������ӣ���D��ȷ��
�ʴ�Ϊ��BD��
��3��A����ȡ���Ʊ�������̽���ϳɼ״����¶Ⱥ�ѹǿ�����������������¶ȡ�ѹǿ�DZ仯�ģ�n(CO)/n(H2)Ӧ���ֲ��䣬����b=1/2���Ƚ�ʹ��1��2��ѹǿ��ͬ�������¶�Ӧ��ͬ����a=200��
�ʴ�Ϊ��200��1/2��
B���¶���ͬʱ������ֱx��ĸ����ߣ�����ѹǿΪPy��CO��ת���ʸߣ���ӦΪǰ�������С�ķ�Ӧ��ѹǿ����ƽ���������С�ķ����ƶ�����������Ӧ�ƶ�������Px��Py������ѹǿPx=5MPa��
�ʴ�Ϊ��5��
��4����CH4��g��+H2O��g��=CO��g��+3H2��g����H=+206.2kJmol-1
��CH4��g��+CO2��g��=2CO��g��+2H2��g����H=+247.4kJmol-1
���ݸ�˹���ɼ��㣬����2-����CH4��H2O��g����Ӧ����CO2��H2���Ȼ�ѧ����ʽΪCH4��g��+2H2O��g��=CO2��g��+4H2��g����H=+165.0kJmol-1��
�ʴ�Ϊ��CH4��g��+2H2O��g��=CO2��g��+4H2��g����H=+165.0kJmol-1��


 ��������ϵ�д�
��������ϵ�д� ��ӡ�Ļ���ʱ����ϵ�д�
��ӡ�Ļ���ʱ����ϵ�д� ��ѧ�����ϵ�д�
��ѧ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ������������й�˵����ȷ����
A. ���³�ѹ�£�1.8g��(��CD3)�к��е�������ΪNA
B. ��״���£�11.2L��ϩ�ͻ�����(C3H6)�Ļ�������У����õ��ӶԵ���ĿΪ3NA
C. ����ͭ�뺬0.4 mol HNO3��Ũ���ᷴӦ������ת��������0.2NA
D. �����£�1L pH=9��CH3COONa��Һ�У����������ˮ������Ϊ1��10��9 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��3-�Լױ���ϩ�����(E)��һ�����ںϳɿ�Ѫ˨ҩ���м���,��ϳ�·����ͼ��

��֪��HCHO+CH3CHO![]() CH2��CHCHO+H2O
CH2��CHCHO+H2O
��1��A��������___����FeCl3��Һ����ɫ�ұ�����������ȡ������A��ͬ���칹����___�֡�B�Ľṹ��ʽ___��D�к��������ŵ�����Ϊ___��
��2���Լ�C��ѡ�������е�___��
a.��ˮ b.������Һ c.����KMnO4��Һ d.����Cu(OH)2����Һ
��3�� ��E��һ��ͬ���칹�壬������������NaOH��Һ���ȵĻ�ѧ����ʽΪ___��
��E��һ��ͬ���칹�壬������������NaOH��Һ���ȵĻ�ѧ����ʽΪ___��
��4��E��һ�������¿������ɸ߾���F��F�Ľṹ��ʽΪ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܸ߷�����ָ����ijЩ�ض����ܵĸ߷��Ӳ��ϡ����ܸ߷��� P �ĺϳ�·�����£�
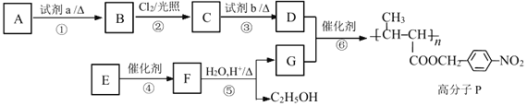
��1��A �Ǽױ����Լ� a ��______����Ӧ�۵ķ�Ӧ����Ϊ______��Ӧ��
��2����Ӧ���� C �IJ�������ƫ�ͣ���ԭ�������______��
��3����Ӧ�Ļ�ѧ����ʽΪ______��
��4��E �ķ���ʽ�� C6H10O2����ṹ��ʽ��______��
��5����ˮ�����۱�ϩ����![]() ��һ�������ܸ߷��Ӳ��ϣ�������ʪ������Ҫ�ɷ֡���ҵ���ñ�ϩ��CH2=CH-CH3��Ϊԭ�����Ʊ��۱�ϩ���ƣ���Ѹúϳ�·�߲������������Լ���ѡ����_________
��һ�������ܸ߷��Ӳ��ϣ�������ʪ������Ҫ�ɷ֡���ҵ���ñ�ϩ��CH2=CH-CH3��Ϊԭ�����Ʊ��۱�ϩ���ƣ���Ѹúϳ�·�߲������������Լ���ѡ����_________
���ϳ�·�߳��õı��﷽ʽΪ��A![]() B
B![]() ����Ŀ����
����Ŀ����
CH2=CH-CH3![]() CH2=CH-CH2Cl
CH2=CH-CH2Cl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��������װ�õĵ缫���Ϻ͵������Һ����ͬ������װ������ͬ���ǣ�������
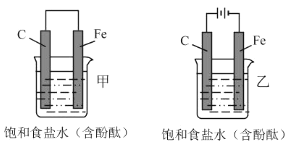
A.��̼�缫���������ĵ缫��ӦB.�����缫��������Һ�ȱ��ɫ
C.�����뵼�����Ӵ��ĵ�������D.̼�缫�Ȳ�����Ҳ�����С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ͼ�ķ���ʽ��ΪC7H8������˵����ȷ����
![]()
A. W��M��N��������ˮ�����ӳɷ�ӦB. W��M��N��һ�ȴ�����Ŀ���
C. W��M��N�����е�̼ԭ�Ӿ�����D. W��M��N����ʹ����KMnO4��Һ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��C��N��S �������ﳣ�����һЩ�������⣬���й����������о��ø��ֻ�ѧ������������Щ���ʶԻ�����Ӱ�졣
(1)CO2 �������� CO2 �� H2 Ϊԭ�Ͽɵõ� CH4 ȼ�ϡ�
��֪: ��CH4 (g)+CO2(g)=2CO(g)+2H2(g) ��H1=+247kJ/mol
��CH4 (g)+H2O(g)=CO(g)+3H2(g) ��H2=+205kJ/mol
д�� CO2 �������Ȼ�ѧ����ʽ��_____��
(2) ����̼���η����������е� SO2
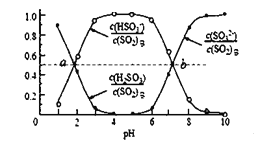
�ٽ�����ͨ�� 1.0mol/L �� Na2SO3 ��Һ�����˹�������Һ������䣬����Һ�� pH ����_____(������С���������� ��������)������Һ pH ԼΪ 6 ʱ������ SO2 �����������½���Ӧ�������ռ�����ʱ��Һ�� c(SO32-) =0.2mol/L�� ����Һ�� c(HSO3-) =_____��
�����������£�������ͨ��(NH4)2SO3 ��Һ�У������Һ pH ���������ʵ��������ı仯��ϵ��ͼ: b ��ʱ��Һ pH=7���� n(NH4+)��n(HSO3��)= ______________ ��
(3)��������ȥ�� NO��һ�������£��� NH3 ���� NO ��Ⱦ���䷴Ӧԭ��4NH3+6NO![]() 5N2+6H2O����ͬ�¶������£�n(NH3):n(NO)�����ʵ���֮�ȷֱ�Ϊ 4:1��3:1��1:3 ʱ���õ� NO �ѳ���������ͼ��ʾ��
5N2+6H2O����ͬ�¶������£�n(NH3):n(NO)�����ʵ���֮�ȷֱ�Ϊ 4:1��3:1��1:3 ʱ���õ� NO �ѳ���������ͼ��ʾ��
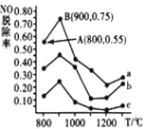
������ a �У�NO ����ʼŨ��Ϊ6��10-4mg��m-3���� A �㵽 B �㾭��0.8s����ʱ����� NO ���ѳ�����Ϊ_____mg��m-3��s-1��
������ b ��Ӧ NH3 �� NO �����ʵ���֮����_____��
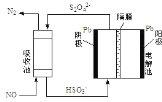
(4)��ӵ绯ѧ���� NO����ԭ����ͼ��ʾ��д�������ĵ缫��Ӧʽ(��������Һ������)_____�����ճ��г�ȥ NO ��ԭ��_____(�����ӷ���ʽ��ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��д��ȷ���� (����)
A. ��ˮ��ͨ��������Cl2��H2O![]() 2H����Cl����ClO��
2H����Cl����ClO��
B. ���Ȼ�����Һ�м���ͭ��2Fe3����3Cu===2Fe��3Cu2��
C. NH4HCO3��Һ�����KOHŨ��Һ���ȣ�NH4����OH��![]() NH3����H2O
NH3����H2O
D. ����������еμ�Ũ���Ტ���ȣ�MnO2��4H����2Cl��![]() Mn2����Cl2����2H2O
Mn2����Cl2����2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.3C(s)+CaO(s)![]() CaC2(s)+CO(g) �ڳ����²����Է����У�˵���÷�Ӧ�ġ�H��0
CaC2(s)+CO(g) �ڳ����²����Է����У�˵���÷�Ӧ�ġ�H��0
B.Ѱ�Ҹ�Ч������ʹˮ�ֽ����������ͬʱ�ͷ�����
C.���º�ѹ���ܱ������н��з�Ӧ��N2(g)+3H2(g)![]() 2NH3(g) ��H=��aKJ/mol��ƽ��ʱ���������ٳ���һ������ NH3�����´ﵽƽ��ʱ a ֵ��С
2NH3(g) ��H=��aKJ/mol��ƽ��ʱ���������ٳ���һ������ NH3�����´ﵽƽ��ʱ a ֵ��С
D.C(g)+H2O(g)![]() CO(g)+H2(g)����H��0����������������ʱ�������¶ȣ�����Ӧ���������淴Ӧ���ʼ�С��ƽ�������ƶ�
CO(g)+H2(g)����H��0����������������ʱ�������¶ȣ�����Ӧ���������淴Ӧ���ʼ�С��ƽ�������ƶ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com