
【题目】下列说法正确的是( )
A.3C(s)+CaO(s)![]() CaC2(s)+CO(g) 在常温下不能自发进行,说明该反应的△H>0
CaC2(s)+CO(g) 在常温下不能自发进行,说明该反应的△H>0
B.寻找高效催化剂,使水分解产生氢气,同时释放能量
C.恒温恒压的密闭容器中进行反应:N2(g)+3H2(g)![]() 2NH3(g) △H=﹣aKJ/mol,平衡时向容器中再充入一定量的 NH3,重新达到平衡时 a 值减小
2NH3(g) △H=﹣aKJ/mol,平衡时向容器中再充入一定量的 NH3,重新达到平衡时 a 值减小
D.C(g)+H2O(g)![]() CO(g)+H2(g)(△H>0),其它条件不变时,升高温度,正反应速率增大,逆反应速率减小,平衡正向移动
CO(g)+H2(g)(△H>0),其它条件不变时,升高温度,正反应速率增大,逆反应速率减小,平衡正向移动
【答案】A
【解析】
A. 3C(s)+CaO(s)![]() CaC2(s)+CO(g) △S>0,在常温下不能自发进行,由G=H-TS,可得出该反应的△H>0,A正确;
CaC2(s)+CO(g) △S>0,在常温下不能自发进行,由G=H-TS,可得出该反应的△H>0,A正确;
B.催化剂只能加快反应速率,缩短反应到达平衡的时间,但不能改变反应的热焓变,水分解产生氢气,仍然吸收热量,B错误;
C. 恒温恒压的密闭容器中进行反应:N2(g)+3H2(g)![]() 2NH3(g) △H=﹣a kJ/mol,平衡时向容器中再充入一定量的 NH3,虽然平衡发生移动,但不改变a 值,C错误;
2NH3(g) △H=﹣a kJ/mol,平衡时向容器中再充入一定量的 NH3,虽然平衡发生移动,但不改变a 值,C错误;
D. C(g)+H2O(g)![]() CO(g)+H2(g)(△H>0),其它条件不变时,升高温度,正反应速率增大,逆反应速率也应增大,D错误。
CO(g)+H2(g)(△H>0),其它条件不变时,升高温度,正反应速率增大,逆反应速率也应增大,D错误。
故选A。


科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有广泛的应用前景。工业上采用下列两种反应合成甲醇:
反应I:CO(g)+2H2(g)![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应II:CO2(g)+3H2(g)![]() CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
(1)下表所列数据是反应I在不同温度下的化学平衡常数(K)。
温度 | 250℃ | 300℃ | 350℃ |
K | 2.04 | 0.25 | 0.012 |
①由表中数据判断ΔH1 _________0 (填“>”、“=”或“<”)。
②某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,5 min后达到平衡,测得c(CO)=0.2 mol/L,则用H2表示的5min内该反应的反应速率v(H2)=_______mol·L-1·min-1,该温度下此反应的平衡常数为___________,此时的温度为________(从上表中选择)。
(2)一定条件下,将1 mol CO与 3 mol H2的混合气体在催化剂作用下能自发反应生成甲醇。若容器容积不变,下列措施可提高CO转化率的是________。
A.升高温度 B.将CH3OH(g)从体系中分离
C.恒容条件下充入He D.再充入适量的 H2
(3)为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
实验编号 | 温度(℃) | n(CO)/n(H2) | 压强(MPa) |
1 | a | 1/2 | 0.2 |
2 | 200 | b | 5 |
3 | 350 | 1/2 | 0.2 |
A.则上表中剩余的实验条件数据:a=________、b=_______。
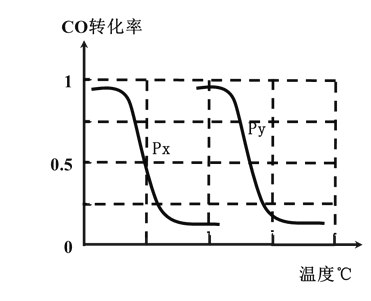
B.根据反应I的特点,左下图是在压强分别为0.2MPa和5MPa下CO的转化率随温度变化的曲线图,请指明图中的压强Py=______MPa。
(4)上述反应中需要用到H2做反应物,以甲烷为原料制取氢气是常用的制氢方法。已知:
①CH4(g) + H2O(g) = CO(g) + 3H2(g) ΔH = +206.2 kJ·mol-1
②CH4(g) + CO2(g) = 2CO(g) + 2H2(g) ΔH = +247.4 kJ·mol-1
则CH4和H2O(g)反应生成CO2和H2的热化学方程式为:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如表:下列说法错误的是:( )
物质 | X | Y | Z |
初始浓度/ | 0.1 | 0.2 | 0 |
平衡浓度/ | 0.05 | 0.05 | 0.1 |
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y![]() 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.改变温度可以改变此反应的平衡常数
D.增压使平衡向生成Z的方向移动,平衡常数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛铁矿主要成分为FeTiO3(含有少量MgO、SiO2等杂质),Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿来制备,工艺流程如下:

(1)钛铁矿在预处理时需要进行粉碎,其原因是___________________。
(2)过程①中反应的离子方程式是: FeTiO3 + 4H++ 4Cl-== Fe2+ + TiOCl42-+ 2H2O、_______。
(3)过程①中,铁的浸出率结果如图1所示。由图可知,当铁的浸出率为80%时,所采用的实验条件是___________________。

(4)过程②中固体TiO2与双氧水、氨水反应转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度的关系如图2所示,反应温度过高时,Ti元素浸出率下降的原因是___________。
(5)在滤液B转化为FePO4沉淀过程中发生以下反应,请配平:
Fe2+ +_____ + H3PO4 ===FePO4 + ____ + _____
(6)过程③中由FePO4制备LiFePO4的化学方程式是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,与盐类水解有关的是( )
①明矾可以做净水剂;
②实验室配制FeCl3溶液时,将FeCl3溶于少量的浓盐酸再加水稀释;
③用NaHCO3和Al2(SO4)3两种溶液可作泡沫灭火剂;
④在NH4Cl溶液中加入金属镁会产生氢气;
⑤草木灰与铵态氮肥不能混合施用;
⑥比较NH4Cl和Na2S等某些盐溶液的酸碱性.
A. ①④⑥ B. ②③⑤ C. ③④⑤ D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某澄清透明溶液中只可能含有①![]() ,②
,②![]() ,③
,③![]() ,④
,④![]() ,⑤
,⑤![]() ,⑥
,⑥![]() ,⑦
,⑦![]() 中的几种,向该溶液中逐滴加入NaOH溶液至过量,生成沉淀的质量与NaOH的物质的量的关系如图所示.则该溶液中一定含有的离子是
中的几种,向该溶液中逐滴加入NaOH溶液至过量,生成沉淀的质量与NaOH的物质的量的关系如图所示.则该溶液中一定含有的离子是
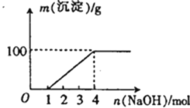
A.②⑤⑥⑦B.②③⑤⑦C.①②③⑥⑦D.①②③④⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,Ka(HCOOH) =1.77×10—4,Ka(CH3COOH) =1.75×10—5,下列说法正确的是
A. pH均为3的HCOOH和盐酸等体积混合后,pH变小
B. 0.2 molL—1 CH3COONa 与 0.1 molL﹣1盐酸等体积混合后的溶液中(pH<7):c(CH3COO—)>c(Cl—)>c(CH3COOH)>c(H+)
C. 0.2 molL—1 HCOOH 与 0.1 molL—1 NaOH 等体积混合后的溶液中:c(HCOO—) +c(HCOOH) =0.2 molL—1
D. 中和浓度和体积均相同的HCOOH和CH3COOH,所用NaOH的物质的量不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W的原子序数依次增大.X原子核内没有中子;Z与W在周期表中同主族,且Y、Z和W三种元素的原子最外层电子数之和为17;X、Y形成的化合物M的水溶液呈碱性.则下列说法不正确的是![]()
A.原子半径:![]()
B.标准状况下的![]() LM溶于水,所得溶液
LM溶于水,所得溶液![]()
C.![]() 能使湿润的淀粉KI试纸变蓝
能使湿润的淀粉KI试纸变蓝
D.一定条件下,Cu可与W的最高价氧化物对应水化物发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用图所示装置检验乙烯时不需要除杂的是

乙烯的制备 | 试剂X | 试剂Y | |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
C | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
D | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | Br2的CCl4溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com