
【题目】下列说法中,与盐类水解有关的是( )
①明矾可以做净水剂;
②实验室配制FeCl3溶液时,将FeCl3溶于少量的浓盐酸再加水稀释;
③用NaHCO3和Al2(SO4)3两种溶液可作泡沫灭火剂;
④在NH4Cl溶液中加入金属镁会产生氢气;
⑤草木灰与铵态氮肥不能混合施用;
⑥比较NH4Cl和Na2S等某些盐溶液的酸碱性.
A. ①④⑥ B. ②③⑤ C. ③④⑤ D. ①②③④⑤⑥
【答案】D
【解析】
:①明矾为硫酸铝钾的结晶水合物,铝离子可水解生成具有吸附性的氢氧化铝胶体,可用作净水剂,故①正确;②氯化铁溶液中铁离子水解显酸性,加入盐酸抑制水解平衡逆向进行,实验室配制FeCl3溶液时,往往在FeCl3溶液中加入少量的盐酸,故②正确;③泡沫灭火剂是碳酸氢钠和硫酸铝溶液混合发生双水解反应生成氢氧化铝沉淀和二氧化碳的原理,故③正确;④氯化铵溶液中铵根离子水解显酸性, NH4Cl+H2ONH3![]() H2O+HCl,加入镁会和盐酸发生反应生成氢气,故④正确;⑤铵根离子和草木灰中的碳酸根离子发生双水解,肥效损耗,草木灰与氨态氮肥不能混合施用,故⑤正确;⑥强酸弱碱盐水解呈酸性,强碱弱酸盐呈碱性,则比较NH4Cl和Na2S等某些盐溶液的酸碱性,是利用盐溶液水解后酸碱性不同,故⑥正确;综上所述①②③④⑤⑥正确; A. ①④⑥;符合题意;B. ②③⑤不符合题意;C. ③④⑤不符合题意;D. ①②③④⑤⑥符合题意;答案:D。
H2O+HCl,加入镁会和盐酸发生反应生成氢气,故④正确;⑤铵根离子和草木灰中的碳酸根离子发生双水解,肥效损耗,草木灰与氨态氮肥不能混合施用,故⑤正确;⑥强酸弱碱盐水解呈酸性,强碱弱酸盐呈碱性,则比较NH4Cl和Na2S等某些盐溶液的酸碱性,是利用盐溶液水解后酸碱性不同,故⑥正确;综上所述①②③④⑤⑥正确; A. ①④⑥;符合题意;B. ②③⑤不符合题意;C. ③④⑤不符合题意;D. ①②③④⑤⑥符合题意;答案:D。


科目:高中化学 来源: 题型:
【题目】有下列七种物质的溶液:
①NaCl ②NH4Cl ③Na2CO3 ④CH3COONa ⑤CH3COOH ⑥NaHCO3
(1)溶液呈酸性的有_____________,呈碱性的有____________,呈中性的有_____________。
(2)写出②④水解的离子方程式:________________________、______________________
(3)常温下,浓度均为0.1mol/L的③和⑥的溶液中离子种类_____________(填相同或是不相同),溶液的PH:③_________⑥(填 >、=或 <)。
(4)常温下0.1 mol/L的CH3COOH溶液加水稀释过程中,下列表达式的数据一定变大的是______________。
A.c(H+) B. C.c(H+)·c(OH-)
C.c(H+)·c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0. 1000 mol·L-1的盐酸滴定20.00 mL未知浓度的Na2CO3溶液,溶液的pH与所加盐酸的体积关系如图所示(饱和H2CO3溶液pH=5.6)。下列有关叙述正确的是
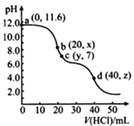
A. 若c(Na2CO3)=0.1000 mol·L-1,则H2CO3的Ka2数量级约为10-6
B. c点处溶液中一定有:c(Na+)=2c(CO32-)+c(HCO3-)
C. a、c两点水的c(OH-)之比为10-11.6 :10-7
D. 若z=5.6,则d点有c(Na+)=c(Cl-)>c(H2CO3)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组进行了下列关于氯化铵的课外实验:
(实验操作)

浸过氯化钠溶液的布条很快烧光,浸过氯化铵溶液的布条不燃烧,冒出白烟。
(1)氯化铵饱和溶液中离子浓度由大到小的顺序是________。白烟的成分是______________。
(2)请推测浸过氯化铵溶液的布条不燃烧、不易着火的主要原因(写出一条即可)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d为短周期元素,原子序数依次增大。25℃时,其最高价氧化物的水化物溶液(浓度均为0.1mol·L-1)的pH和原子序数的关系如图所示。下列有关说法正确的是

A. 简单离子半径:b>a
B. d元素氧化物的水化物一定是强酸
C. 气态氢化物的稳定性:d>c
D. b、c的简单离子都能破坏水的电离平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O![]() Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
A.充电时阳极反应:Ni(OH)2 -e— + OH- = NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可用软锰矿(主要成分是MnO2)和黄铁矿(主要成分是FeS2)为主要原料制备高性能磁性材料碳酸锰(MnCO3)。其工业流程如下:

回答下列问题:
(1)为了提高溶浸工序中原料的浸出率,除了可以搅拌、将矿石研磨粉碎以外,可以采取的措施有(写两条)________________。
(2)副产品A的化学式是________________。
(3)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质。若测得滤液中c(F-)=0.01 mol·L-1,则滤液中残留的c(Ca2+)=________________〔已知:Ksp(CaF2)=1.46×10-10〕。
(4)沉锰工序中,加入NH4HCO3后有无色无味的气体放出,同时有浅红色的沉淀生成,发生反应的离子方程式是________________;沉锰工序中判断沉淀已经洗涤干净的实验操作是________________。
(5)已知MnCO3难溶于水和乙醇,潮湿时易被空气氧化,100℃开始分解。工业上一般用少量C2H5OH洗涤的原因是________________。
(6)溶浸过程中发生的主要反应如下,请完成并配平该反应的离子方程式:_____________ FeS2+_____________ MnO2+_____________ =_____________ Fe3++_____________ Mn2++_____________ SO42-+_____________ ,___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列盐溶液水解的离子方程式
(1)次氯酸钾(KClO)溶液__________________________________________________;
(2)磷酸钠(Na3PO4)溶液___________________________________________________;
(3)明矾净水水解原理____________________________________________;
(4)硫酸铁溶液__________________________________________
(5)泡沫灭火器的原理__________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大。其中X与Y可形成一种淡黄色物质P,常温下将0.05 mol P溶于水,配成1 L溶液,其中![]() =1×10-12;Z为金属元素,且Z可在W的一种氧化物中燃烧,生成一种白色的物质和一种黑色的物质。下列说法错误的是
=1×10-12;Z为金属元素,且Z可在W的一种氧化物中燃烧,生成一种白色的物质和一种黑色的物质。下列说法错误的是
A. 简单离子半径:X>Y>Z
B. 氢化物的沸点:W<X
C. 化合物P中既含有离子键又含有共价键
D. W、X、Y三种元素形成的物质的水溶液显碱性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com