
【题目】短周期元素X、Y、Z、W的原子序数依次增大.X原子核内没有中子;Z与W在周期表中同主族,且Y、Z和W三种元素的原子最外层电子数之和为17;X、Y形成的化合物M的水溶液呈碱性.则下列说法不正确的是![]()
A.原子半径:![]()
B.标准状况下的![]() LM溶于水,所得溶液
LM溶于水,所得溶液![]()
C.![]() 能使湿润的淀粉KI试纸变蓝
能使湿润的淀粉KI试纸变蓝
D.一定条件下,Cu可与W的最高价氧化物对应水化物发生反应
【答案】B
【解析】
短周期元素X、Y、Z、W的原子序数依次增大,X原子核内没有中子,则X为H元素;X、Y形成的化合物M的水溶液呈碱性,则Y是N元素,M为![]() ;
;
Z与W在周期表中同主族,且Y、Z和W三种元素的原子最外层电子数之和为17,则Z和W最外层电子数都是6,且Z原子序数小于W,所以Z是O、W是S元素。
A.原子电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小,所以原子半径:![]() ,故A不符合题意;
,故A不符合题意;
B.标况下![]() 氨气的物质的量是
氨气的物质的量是![]() ,
,![]() 氨气溶于水得到氨水,溶液的体积未知导致无法计算氨水物质的量浓度,且一水合氨是弱电解质,部分电离,所以无法计算溶液的pH,故B符合题意;
氨气溶于水得到氨水,溶液的体积未知导致无法计算氨水物质的量浓度,且一水合氨是弱电解质,部分电离,所以无法计算溶液的pH,故B符合题意;
C.![]() 具有氧化性,能氧化碘离子生成碘单质,碘遇淀粉试液变蓝色,所以
具有氧化性,能氧化碘离子生成碘单质,碘遇淀粉试液变蓝色,所以![]() 能使湿润的淀粉KI试纸变蓝,故C不符合题意;
能使湿润的淀粉KI试纸变蓝,故C不符合题意;
D.W是S元素,其最高价氧化物的水化物是硫酸,加热条件下,Cu能和浓硫酸反应生成硫酸铜、二氧化硫和水,故D不符合题意;
故选:B。


 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是 ( )
A. 向水中通入氯气:Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
B. 向氯化铁溶液中加入铜:2Fe3++3Cu===2Fe+3Cu2+
C. NH4HCO3溶液与过量KOH浓溶液共热:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
D. 向二氧化锰中滴加浓盐酸并加热:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.3C(s)+CaO(s)![]() CaC2(s)+CO(g) 在常温下不能自发进行,说明该反应的△H>0
CaC2(s)+CO(g) 在常温下不能自发进行,说明该反应的△H>0
B.寻找高效催化剂,使水分解产生氢气,同时释放能量
C.恒温恒压的密闭容器中进行反应:N2(g)+3H2(g)![]() 2NH3(g) △H=﹣aKJ/mol,平衡时向容器中再充入一定量的 NH3,重新达到平衡时 a 值减小
2NH3(g) △H=﹣aKJ/mol,平衡时向容器中再充入一定量的 NH3,重新达到平衡时 a 值减小
D.C(g)+H2O(g)![]() CO(g)+H2(g)(△H>0),其它条件不变时,升高温度,正反应速率增大,逆反应速率减小,平衡正向移动
CO(g)+H2(g)(△H>0),其它条件不变时,升高温度,正反应速率增大,逆反应速率减小,平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常采用点滴板来完成部分实验,既可节约药品,又便于观察实验现象,图中所示的实验现象描述正确的是
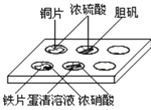
①装有铜片的孔穴中溶液呈蓝色
②装有胆矾的孔穴中固体的颜色变浅
③装有铁片的孔穴中溶液呈浅绿色
④装有蛋清溶液的孔穴中溶液呈黄色。
A.①B.②③C.①④D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语的相关表述中正确的是
A. 因H+(aq) +OH- (aq)==H2O(l) △H=-akJ·mol-1,故1molNaOH固体与足量的稀盐酸反应,放出的热量为akJ
B. 因CuSO4·5H2O(s)==CuSO4(s)+5H2O(1)△H=+bkJ·mol-1,故1molCuSO4(s)溶于水时,放出的热量为bkJ
C. 因氢气的燃烧热为c kJ·mol-1,故水电解的热化学方程式为2H2O (l)==2H2(g)+O2(g) △H=+c kJ·mol-1
D. 因N2(g)+3H2(g)![]() 2NH3(g) △H=-d kJ·mol-1,故在某容器中通入1molN2与3molH2充分反应后,放出的热量小于dkJ
2NH3(g) △H=-d kJ·mol-1,故在某容器中通入1molN2与3molH2充分反应后,放出的热量小于dkJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-41 kJ/mol
CO2(g)+H2(g) △H=-41 kJ/mol
某小组研究在相同温度下该反应过程中的能量变化。他们分别在体积均为VL的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应。相关数据如下:
容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | |||
CO | H2O | CO2 | H2 | |||
① | 1 | 4 | 0 | 0 | t1 | 放出热量:32.8 kJ |
② | 2 | 8 | 0 | 0 | t2 | 放出热量:Q |
(1)该反应过程中,反应物分子化学键断裂时所吸收的总能量_____________(填“大于”、“小于”或“等于”)生成物分子化学键形成时所释放的总能量。
(2)容器①中反应达平衡时,CO的转化率为_____________。
(3)计算容器①中反应的平衡常数K=_____________。某时刻测得②中氢气的物质的量为1.8mol,请问此刻V正 V逆(填大于,小于或等于)
(4)下列叙述正确的是_____________(填字母序号)。
a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q > 65.6 kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.平衡时,两容器中CO的转化率相同
(5)已知:2H2(g)+O2(g)=2H2O(g)ΔH=-484kJ/mol,请写出CO完全燃烧生成CO2的热化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定烧碱的纯度,进行以下滴定操作:
A.在250mL容量瓶中定容成250mL烧碱溶液
B.用移液管移取25mL烧碱溶液于锥形瓶中并滴加几滴酚酞指示剂
C.在天平上准确称取烧碱样品W g,在烧杯中加蒸馏水溶解
D.将物质的量浓度为M mol·L-1的标准HCl溶液装入酸式滴定管,调整液面,记下开始刻度数为V1mL
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点酸的体积V2mL
回答下列问题:
(1)正确的操作步骤的顺序是(用字母填写)________→________→________→D→________
(2)使用滴定管之前应进行的操作是________
(3)操作E中的锥形瓶下垫一张白纸的作用是________
(4)若酸式滴定管未用盐酸标准溶液润洗,会对测定结果有何影响________(填“偏高”、“偏低”或“无影响”)
(5)该烧碱样品的纯度计算式________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年第26届国际计量大会(CGPM)对国际单位制进行了修改,将阿伏加德常数变为了精确数值,用原子来定义千克。研究者们使用激光测量“硅球"球体点阵中一个晶格单位的长度和硅原子的平均直径,从而确定一定 质量的纯硅球体中准确的原子数。
(1)基态硅原子的核外电子排布式是_____________________。基态的气态原子失去一个电子形成气态一价正离子时所需能量称为元素的第一电离能(I1),元素气态一价正离子失去一个电子形成气态二价正离子时所需能量称为元素的第二电离能(I2),…… .以此类推。下列电离能比值最大的是_____________
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
(2)晶体硅具有金刚石型结构,其中硅原子的杂化方式是_______,晶体硅中硅原子与σ键的数目比是___________。
(3)组成为Na2O·Al2O3·2SiO2·nH2O的铝硅酸盐是一种常见的分子筛。O、Al、Si 电负性
由小到大的顺序是___________________。
(4)硅与碳是同主族元素,碳原子与碳原子之间可以形成单键、双键和三键,但硅原子之间却不容易形成双键和三键,原因是________________________。
(5)硅晶胞结构如图所示,则晶胞中含有___个硅原子。 硅晶体的密度为ρ gcm—3,硅的摩尔质量为 M g·mol-1, 经测定,晶胞边长为a pm,则阿伏加德罗常数可表示为:NA=__mol—1。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法对应的离子方程式合理的是
A. 纯碱溶液去油污:CO32-+H2O=HCO3-+OH-
B. 泡沫灭火器工作原理:2Al3++3CO32-+3H2O= 2A1(OH)3↓+3CO2↑
C. 明矾溶液中加入过量的氢氧化钡溶液:Al3++SO42-+Ba2++4OH-=BaSO4↓+AlO2-+2H2O
D. 用石墨为电极,电解Pb(NO3)2和Cu(NO3)2的混合溶液制取PbO2时,阳极上发生的电极反应式:Pb2++2 H2O-2e-=PbO2+4H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com