
【题目】实验室常采用点滴板来完成部分实验,既可节约药品,又便于观察实验现象,图中所示的实验现象描述正确的是
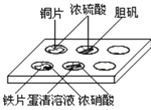
①装有铜片的孔穴中溶液呈蓝色
②装有胆矾的孔穴中固体的颜色变浅
③装有铁片的孔穴中溶液呈浅绿色
④装有蛋清溶液的孔穴中溶液呈黄色。
A.①B.②③C.①④D.②④
科目:高中化学 来源: 题型:
【题目】在水的电离平衡中,c(H+)和c(OH)的关系如图所示:
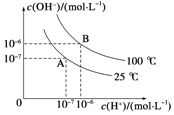
(1)A点水的离子积为1×1014mol2/L2,B点水的离子积为_______.造成水的离子积变化的原因是________。
(2)100℃时,若向溶液中滴加盐酸,能否使体系处于B点位置?为什么?_______ ; ______.
(3)100℃时,若盐酸中c(H+)=5×104mol/L,则由水电离产生的c(H+)是________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛铁矿主要成分为FeTiO3(含有少量MgO、SiO2等杂质),Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿来制备,工艺流程如下:

(1)钛铁矿在预处理时需要进行粉碎,其原因是___________________。
(2)过程①中反应的离子方程式是: FeTiO3 + 4H++ 4Cl-== Fe2+ + TiOCl42-+ 2H2O、_______。
(3)过程①中,铁的浸出率结果如图1所示。由图可知,当铁的浸出率为80%时,所采用的实验条件是___________________。

(4)过程②中固体TiO2与双氧水、氨水反应转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度的关系如图2所示,反应温度过高时,Ti元素浸出率下降的原因是___________。
(5)在滤液B转化为FePO4沉淀过程中发生以下反应,请配平:
Fe2+ +_____ + H3PO4 ===FePO4 + ____ + _____
(6)过程③中由FePO4制备LiFePO4的化学方程式是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某澄清透明溶液中只可能含有①![]() ,②
,②![]() ,③
,③![]() ,④
,④![]() ,⑤
,⑤![]() ,⑥
,⑥![]() ,⑦
,⑦![]() 中的几种,向该溶液中逐滴加入NaOH溶液至过量,生成沉淀的质量与NaOH的物质的量的关系如图所示.则该溶液中一定含有的离子是
中的几种,向该溶液中逐滴加入NaOH溶液至过量,生成沉淀的质量与NaOH的物质的量的关系如图所示.则该溶液中一定含有的离子是
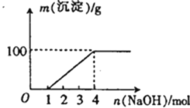
A.②⑤⑥⑦B.②③⑤⑦C.①②③⑥⑦D.①②③④⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,Ka(HCOOH) =1.77×10—4,Ka(CH3COOH) =1.75×10—5,下列说法正确的是
A. pH均为3的HCOOH和盐酸等体积混合后,pH变小
B. 0.2 molL—1 CH3COONa 与 0.1 molL﹣1盐酸等体积混合后的溶液中(pH<7):c(CH3COO—)>c(Cl—)>c(CH3COOH)>c(H+)
C. 0.2 molL—1 HCOOH 与 0.1 molL—1 NaOH 等体积混合后的溶液中:c(HCOO—) +c(HCOOH) =0.2 molL—1
D. 中和浓度和体积均相同的HCOOH和CH3COOH,所用NaOH的物质的量不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国古代科技十分发达,下列对古文献的解释不正确的是
序号 | 古文 | 解释 |
A | 烧酒非古法也,自元时创始,其法用浓酒和糟入甑 | 白酒 |
B | 白青 | 可以用铁来冶炼铜 |
C | 初,人不知盖泥法,元时南安有黄长者为宅煮糖,宅垣忽坏,去土而糖白,后人遂效之 | 蔗糖的分离提纯采用了黄泥来吸附红糖中的色素 |
D | 丹砂烧之成水银,积变又成丹砂 | 加热时丹砂 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W的原子序数依次增大.X原子核内没有中子;Z与W在周期表中同主族,且Y、Z和W三种元素的原子最外层电子数之和为17;X、Y形成的化合物M的水溶液呈碱性.则下列说法不正确的是![]()
A.原子半径:![]()
B.标准状况下的![]() LM溶于水,所得溶液
LM溶于水,所得溶液![]()
C.![]() 能使湿润的淀粉KI试纸变蓝
能使湿润的淀粉KI试纸变蓝
D.一定条件下,Cu可与W的最高价氧化物对应水化物发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组对人教版教材实验“在200mL烧杯中放入20g蔗糖(C12H22O11),加入适量水,搅拌均匀,然后再加入15mL质量分数为98%浓硫酸,迅速搅拌”进行如下探究;
(1)观察现象:蔗糖先变黄,再逐渐变黑,体积膨胀,形成疏松多孔的海绵状黑色物质,同时闻到刺激性气味,按压此黑色物质时,感觉较硬,放在水中呈漂浮状态,同学们由上述现象推测出下列结论:
①浓硫酸具有强氧化性 ②浓硫酸具有吸水性 ③浓硫酸具有脱水性④浓硫酸具有酸性 ⑤黑色物质具有强吸附性
其中依据不充分的是_________(填序号);
(2)为了验证蔗糖与浓硫酸反应生成的气态产物,同学们设计了如下装置:

试回答下列问题:
①图1的A中最好选用下列装置_________(填编号);
②图1的 B装置所装试剂是_________;D装置中试剂的作用是_________;E装置中发生的现象是_________;
③图1的A装置中使蔗糖先变黑的化学反应方程式为_________,后体积膨胀的化学方程式为:_________;
④某学生按图2进行实验时,发现D瓶品红不褪色,E装置中有气体逸出,F装置中酸性高锰酸钾溶液颜色变浅,推测F装置中酸性高锰酸钾溶液颜色变浅的原因_________,其反应的离子方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaNO2是一种白色易溶于水的固体,溶液呈碱性,其外观与氯化钠相似,有咸味,俗称工业盐;是一 种重要的化学试剂、漂白剂和食品添加剂。已知亚硝酸盐能被溴水氧化,在酸性条件下能氧化亚铁离子; 亚硝酸银是可溶于稀硝酸的白色沉淀。
请完成以下填空:
(1)N原子最外层电子的轨道排布式为_______;用一个事实说明氮和氧非金属强弱_______。
(2)酸性条件下,NaNO2溶液只能将I-氧化为I2,同时生成NO。写出此反应①的离子方程式并标出电子转移的方向和数目______。
(3)氯气、浓硝酸、酸性高锰酸钾等都是常用的强氧化剂,工业上氧化卤水中的I-提取单质I2选择了价格并不便宜的亚硝酸钠,可能的原因是_______。
(4)在盐酸溶液中加入亚硝酸钠溶液至中性,则c(Cl-)_____c(HNO2)(填“<”、“>”或“=”)。
(5)设计一种鉴别亚硝酸钠和氯化钠的实验方案。_______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com