
【题目】在一固定容积的密闭容器中,可逆反应: H2(g) + I2(g) ![]() 2HI (g)达到平衡的标志是
2HI (g)达到平衡的标志是
A. H2、I2、HI的分子数之比为1∶1∶2
B. 混合气体的密度保持不变
C. 单位时间生成n mol H2,同时消耗2n mol HI
D. 混合气体的颜色不再发生变化
【答案】D
【解析】
A.反应H2(g) + I2(g)![]() 2HI (g)是一个反应前后气体体积相等的反应。当H2、I2、HI的分子数之比为1∶1∶2时反应可能达到平衡,也可能未达到平衡,故不能作为判断平衡的标志。故A错误;
2HI (g)是一个反应前后气体体积相等的反应。当H2、I2、HI的分子数之比为1∶1∶2时反应可能达到平衡,也可能未达到平衡,故不能作为判断平衡的标志。故A错误;
B.容器的容积不变,无论是否反应混合气体的质量不变,所以密度也就保持不变。所以不能作为判断平衡状态的标志。故B错误;
C.在任何时刻,单位时间每生成n mol H2,必同时消耗2n mol HI,这是反应逆向进行时二者计量系数的关系,不能作为判断平衡状态的标志。故C错误;
D.在H2、I2、HI三种分子中只有I2是有颜色的。由于容器的容积固定不变,所以当混合气体的颜色不再发生变化,说明c(I2)不变,反应达到平衡状态。故D正确。
本题选D。


 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案科目:高中化学 来源: 题型:
【题目】常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是

A.在任何溶液中,c(Ca2+)、c(SO42-)均相等
B.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3mol/L
C.a点对应的Ksp等于c点对应的Ksp
D.d点溶液通过蒸发可以变到c点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是()
A.![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
B.由水电离的c(H+)=1×10-14mol/L的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
C.![]()
![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
D.![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关从海带中提取碘的实验原理和装置能达到实验目的的是

A. 用装置甲灼烧碎海带
B. 用装置乙过滤海带灰的浸泡液
C. 用装置丙制备用于氧化浸泡液中I的Cl2
D. 用装置丁吸收氧化浸泡液中I后的Cl2尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组制备高铁酸钾(K2FeO4)并探究其性质。查阅文献,得到以下资料: K2FeO4为紫色固体,微溶于 KOH 溶液;具有强氧化性,在酸性或中性溶液中快速产生 O2,在碱性溶液中较稳定。
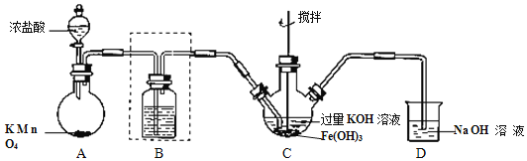
Ⅰ.制备 K2FeO4(夹持装置略)。
(1)A 为氯气的实验室发生装置。A 中反应方程式是______(锰被还原为 Mn2+)。若反应中有 0.5molCl2产生,则电子转移的数目为______。工业制氯气的反应方程式为______。
(2)装置 B 中盛放的试剂是______,简述该装置在制备高铁酸钾中的作用______。
(3)C 中得到紫色固体和溶液。C 中 Cl2发生的反应有:3Cl2+2Fe(OH)3+10KOH→2K2FeO4+6KCl+8H2O,根据该反应方程式得出:碱性条件下,氧化性 Cl2______FeO42-(填“>”或“<”)。另外C中还可能发生其他反应,请用离子方程式表示______。
Ⅱ.探究 K2FeO4 的性质
(4)甲同学取少量 K2FeO4 加入浑浊的泥浆水中,发现产生气体,搅拌,浑浊的泥浆水很快澄清。请简述 K2FeO4的净水原理。______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲乙两装置的电极材料和电解质溶液均相同,则两装置中相同的是( )
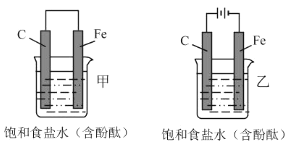
A.在碳电极上所发生的电极反应B.在铁电极附近的溶液先变红色
C.铁极与导线连接处的电流方向D.碳电极既不会变大也不会减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,现有氨水和盐酸两溶液。回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中 ________。(增大、减小、不变)
________。(增大、减小、不变)
(2)若向该氨水中加入氢氧化钠固体,则该电离平衡向_________方向移动(分子化、离子化),电离平衡常数______________。(增大、减小或不变)
(3)0.2 mol/L氨水和0.2 mol/L 盐酸溶液与等体积混合,溶液呈_____性 (酸、碱、中) ;其原因用离子方程式表示为__________________。混合液中,c(NH4+)+c(NH3H2O)=_______mol/L。(忽略体积变化)。请根据电荷守恒写出一个用离子浓度表示的等式_____________________。
(4)用0.1000mol/L HCl溶液滴定未知浓度的NaOH溶液,重复三次的实验数据如下所示
序号 | 0.100mol/L HCl溶液体积/mL | 待测NaOH溶液体积/mL |
1 | 27.83 | 25.00 |
2 | 26.53 | 25.00 |
3 | 27.85 | 25.00 |
该滴定可以使用的指示剂是__________;达到滴定终点时的现象是____________________。
待测NaOH溶液的物质的量浓度为_____________mol/L。(保留四位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器内,使1molN2和3molH2混合发生下列反应:3H2+N2![]() 2NH3△H<0。
2NH3△H<0。
(1)合成氨时选择500℃高温的目的是______________。
(2)当反应达到平衡时,N2和H2的浓度比是_______。
(3)当达到平衡吋,充入氩气,并保持体积不变,平衡将______移动。
(4)当达到平衡时,充入氩气,并保持压强不变,平衡将______移动,反应速率将_______。
(5)当达到平衡时,充入N2并保持体积不变,平衡将______移动。
(6)当达到平衡时,保持体积不变,升高温度时,混合气体的平均相对分子质量_______(选填“增大”“减小”或“不变”,后同),密度________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液,一定呈中性的是
A. 由等体积、等物质的量浓度的硫酸跟NaOH溶液混合后所形成的溶液
B. c(H+)=1.0×10-7mol·L-1的溶液
C. pH=7的溶液
D. c(H+)=![]() 的溶液(Kw为该温度下水的离子积常数)
的溶液(Kw为该温度下水的离子积常数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com