
【题目】常温下,现有氨水和盐酸两溶液。回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中 ________。(增大、减小、不变)
________。(增大、减小、不变)
(2)若向该氨水中加入氢氧化钠固体,则该电离平衡向_________方向移动(分子化、离子化),电离平衡常数______________。(增大、减小或不变)
(3)0.2 mol/L氨水和0.2 mol/L 盐酸溶液与等体积混合,溶液呈_____性 (酸、碱、中) ;其原因用离子方程式表示为__________________。混合液中,c(NH4+)+c(NH3H2O)=_______mol/L。(忽略体积变化)。请根据电荷守恒写出一个用离子浓度表示的等式_____________________。
(4)用0.1000mol/L HCl溶液滴定未知浓度的NaOH溶液,重复三次的实验数据如下所示
序号 | 0.100mol/L HCl溶液体积/mL | 待测NaOH溶液体积/mL |
1 | 27.83 | 25.00 |
2 | 26.53 | 25.00 |
3 | 27.85 | 25.00 |
该滴定可以使用的指示剂是__________;达到滴定终点时的现象是____________________。
待测NaOH溶液的物质的量浓度为_____________mol/L。(保留四位有效数字)
【答案】减小 分子化 不变 酸 NH4++H2O≒NH3H2O 0.1 c(NH4+)+c(Cl-)=c(H+)+c(OH—) 酚酞溶液 当滴入最后一点盐酸溶液,溶液由浅红色变为无色且半分钟内不恢复为原色 0.1114
【解析】
:(1)由于(NH4)2SO4=2NH4++SO42-,溶液中NH4+浓度增大,抑制氨水电离,导致溶液中氢氧根离子浓度减小,氨水分子浓度增大,所以此时溶液中液中中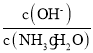 减小;
减小;
故答案为:减小;
(2)氨水中存在NH3+H2ONH3H2ONH4++OH-,向氨水中加入含有氢氧根离子的氢氧化钠固体抑制一水合氨电离,所以NH3H2O的电离平衡向分子化移动,在该过程中,温度不变,则电离平衡常数不变,
故答案为:分子化;不变;
(3)0.2 mol/L氨水和0.2 mol/L 盐酸溶液与等体积混合后溶液中的溶质为NH4Cl,由于铵根会水解:![]() ,所以溶液显酸性;根据物料守恒可知 c(NH4+)+c(NH3H2O)=c(Cl-),混合后c(Cl-)=0.2 mol/L/2=0.1mol/L,所以c(NH4+)+c(NH3H2O)= 0.1mol/L;溶液中的电荷守恒为:c(NH4+)+c(Cl-)=c(H+)+c(OH—),
,所以溶液显酸性;根据物料守恒可知 c(NH4+)+c(NH3H2O)=c(Cl-),混合后c(Cl-)=0.2 mol/L/2=0.1mol/L,所以c(NH4+)+c(NH3H2O)= 0.1mol/L;溶液中的电荷守恒为:c(NH4+)+c(Cl-)=c(H+)+c(OH—),
故答案为:酸;![]() ;0.1;c(NH4+)+c(Cl-)=c(H+)+c(OH—)
;0.1;c(NH4+)+c(Cl-)=c(H+)+c(OH—)
(4)氢氧化钠与HCl恰好中和溶液的pH为7,可选择酚酞溶液做指示剂;滴定终点的现象为:当滴入最后一点盐酸溶液,溶液由浅红色变为无色且半分钟内不恢复为原色;第二组数据误差较大,应该舍弃,则另外两次消耗盐酸的平均体积为:V(HCl)=(27.83+27.85)/2=27.84mL,![]() =0.1114mol/L;
=0.1114mol/L;
故答案为:酚酞溶液;当滴入最后一点盐酸溶液,溶液由浅红色变为无色且半分钟内不恢复为原色;0.1114。


科目:高中化学 来源: 题型:
【题目】钴、镍与铁是同族元素,它们的单质及化合物的性质有很多相似之处。
(1)为了比较Fe、Co、Cu三种金属的活动性,某实验小组设计如下甲、乙、丙三个实验装置。丙装置中X、Y均为石墨电极。反应一段时间后,可观察到甲装置中Co电极附近产生气泡,丙装置中X极附近溶液变红。
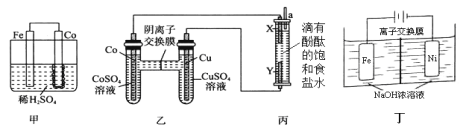
①甲池Fe电极反应式为_________。由现象可知三种金属的活动性由强到弱的顺序是__________(填元素符号)。
②写出丙装置中反应的离子方程式____________________。
(2)Na2FeO4具有广泛用途,可通过电解法制取得到,工作原理图丁所示。通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。已知: Na2FeO4只在强碱性条件下稳定,易被H2还原。
①Fe电极反应式为________。
②电解过程中,须将阴极产生的气体及时排出,其原因是_______________。
③当阴极产生112mL(标准状况)的气体时,通过阴离子交换膜的离子有_______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.NaCl(aq)![]() Cl2(g)
Cl2(g)![]() FeCl2(s)
FeCl2(s)
B.S(s)![]() SO3(g)
SO3(g)![]() H2SO4(aq)
H2SO4(aq)
C.Al(s)![]() AlCl3(aq)
AlCl3(aq)![]() Al(OH)3(s)
Al(OH)3(s)
D.N2(g)![]() NH3(g)
NH3(g)![]() Na2CO3(s)
Na2CO3(s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一固定容积的密闭容器中,可逆反应: H2(g) + I2(g) ![]() 2HI (g)达到平衡的标志是
2HI (g)达到平衡的标志是
A. H2、I2、HI的分子数之比为1∶1∶2
B. 混合气体的密度保持不变
C. 单位时间生成n mol H2,同时消耗2n mol HI
D. 混合气体的颜色不再发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型陶瓷材料氮化硅(Si3N4)可用于制作火箭发动机中燃料的喷嘴。氮化硅可由石英、焦炭在高温氮气流中制取。完成下列填空:______SiO2+______C+______N2![]() ______Si3N4+______CO。
______Si3N4+______CO。
(1)试配平该化学反应方程式,将系数填写在对应位置上。在方程式上标出电子转移的方向和数目。____________
(2)反应中______被还原,当氧化产物比还原产物多 1mol 时,反应中电子转移数为______。
(3)在该反应体系中:所涉及物质属于非极性分子的电子式为______;所涉及元素中原子半径最大的原子的最外层电子排布式为______。
(4)反应的主要产物氮化硅所属的晶体类型为______,证明氮化硅组成元素非金属性强弱:
(Ⅰ)写出一个化学事实______;
(Ⅱ)从原子结构上进行说明:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关盐类水解的说法中,不正确的是( )。
A. 盐类的水解过程破坏了纯水的电离平衡
B. 盐类的水解是酸碱中和反应的逆反应
C. 盐类水解后的溶液不一定显中性
D. ![]() 溶液中,
溶液中, ![]() 是
是![]() 的两倍
的两倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容容器中发生N2O4(g)2NO2(g),若反应物的浓度由0.1molL﹣1降到0.06molL﹣1需20s,那么由0.06molL﹣1降到0.036molL﹣1,所需反应时间为( )
A. 10 sB. 12 sC. 大于12 sD. 小于12 s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.NaClO溶液与FeCl2溶液混合:Fe2++2ClO-+2H2O===Fe(OH)2↓ + 2HClO
B.苯酚钠溶液中通入少量CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3-
C.澄清石灰水与过量NaHCO3溶液反应:HCO3-+Ca2++OH-===CaCO3↓+H2O
D.铵明矾[NH4Al(SO4)2·12H2O]溶液中加入过量Ba(OH)2溶液: Al3++2(SO4)2-+2Ba2++4OH-===AlO2-+2BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的转化在指定条件下能实现的是
①Cu![]() Cu2(OH)2CO3
Cu2(OH)2CO3![]() CuO
CuO
②CaCl2(aq) ![]() CaCO3
CaCO3![]() CaSiO3
CaSiO3
③MgO![]() MgCl2(aq)
MgCl2(aq) ![]() MgCl2(s)
MgCl2(s)
④N2![]() NO2
NO2![]() HNO3
HNO3
⑤Cl2![]() NaClO
NaClO![]() Cl2
Cl2
A.①④⑤B.①②⑤C.②③⑤D.①②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com