
【题目】新型陶瓷材料氮化硅(Si3N4)可用于制作火箭发动机中燃料的喷嘴。氮化硅可由石英、焦炭在高温氮气流中制取。完成下列填空:______SiO2+______C+______N2![]() ______Si3N4+______CO。
______Si3N4+______CO。
(1)试配平该化学反应方程式,将系数填写在对应位置上。在方程式上标出电子转移的方向和数目。____________
(2)反应中______被还原,当氧化产物比还原产物多 1mol 时,反应中电子转移数为______。
(3)在该反应体系中:所涉及物质属于非极性分子的电子式为______;所涉及元素中原子半径最大的原子的最外层电子排布式为______。
(4)反应的主要产物氮化硅所属的晶体类型为______,证明氮化硅组成元素非金属性强弱:
(Ⅰ)写出一个化学事实______;
(Ⅱ)从原子结构上进行说明:______。
【答案】![]() N2 2.4NA
N2 2.4NA ![]() 3s23p2 原子晶体 HNO3为强酸,H2SiO3为弱酸(或Si3N4中Si为+4价、N为-3价等) 相对原子半径小的N原子最外层有5个电子,形成稳定结构得3个电子,相对原子半径大的Si原子最外层有4个电子,形成稳定结构要得4个电子,得电子形成稳定结构时Si比N更难
3s23p2 原子晶体 HNO3为强酸,H2SiO3为弱酸(或Si3N4中Si为+4价、N为-3价等) 相对原子半径小的N原子最外层有5个电子,形成稳定结构得3个电子,相对原子半径大的Si原子最外层有4个电子,形成稳定结构要得4个电子,得电子形成稳定结构时Si比N更难
【解析】
(1)由产物CO可知,SiO2与C化学计量数之比为1:2。由产物Si3N4可知SiO2与N2化学计量数之比为3:2,所以SiO2、C、N2化学计量数之比为3:6:2,令SiO2的化学计量数为3,C、N2化学计量数分别为6、2,结合元素守恒可知Si3N4、CO化学计量数分别为1、6,配平后方程式为3SiO2+6C+2N2 Si3N4+6CO,其中N的化合价降低,则N2发生得电子的还原反应,C发生失电子的氧化反应,反应中共转移12e-,电子转移的方向和数目为
Si3N4+6CO,其中N的化合价降低,则N2发生得电子的还原反应,C发生失电子的氧化反应,反应中共转移12e-,电子转移的方向和数目为![]() ;
;
(2)反应3SiO2+6C+2N2 Si3N4+6CO中N元素化合价降低,N2发生还原反应,Si3N4为还原产物、CO为氧化产物,生成6molCO和1molSi3N4时,共转移12mole-,所以当氧化产物比还原产物多1mol时,反应中转移
Si3N4+6CO中N元素化合价降低,N2发生还原反应,Si3N4为还原产物、CO为氧化产物,生成6molCO和1molSi3N4时,共转移12mole-,所以当氧化产物比还原产物多1mol时,反应中转移![]() =2.4mol电子,即转移电子数电子数为2.4NA;
=2.4mol电子,即转移电子数电子数为2.4NA;
(3)反应3SiO2+6C+2N2 Si3N4+6CO中,N2为非极性分子,结构式为N≡N,电子式为
Si3N4+6CO中,N2为非极性分子,结构式为N≡N,电子式为![]() ,Si的原子半径最大,最外层电子的4个电子排布于3s、3p能级上,即排布式为3s23p2;
,Si的原子半径最大,最外层电子的4个电子排布于3s、3p能级上,即排布式为3s23p2;
(4)氮化硅(Si3N4)是共价化合物,可用于制作火箭发动机中燃料的喷嘴,说明其熔点高,所以氮化硅为原子晶体;
(I)比较N、Si非金属性强弱,可根据元素的最高价含氧酸的酸性强弱判断,酸性越强,则元素的非金属性越强,即它们的最高价氧化物对应水化物中,HNO3为强酸,H2SiO3为弱酸;
(Ⅱ)由于N原子半径小,Si原子半径大,形成稳定结构时N得电子的能力强,即得电子能力强的N原子的非金属性强于Si,导致Si3N4中Si为+4价、N为-3价。


科目:高中化学 来源: 题型:
【题目】25℃时,电离平衡常数如下表,下列说法错误的是
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 |
A.离子结合质子的能力由大到小的顺序是:CO32- > ClO- > HCO3- > CH3COO-
B.2ClO-+CO2+H2O=CO32-+2HClO反应不能发生
C.用蒸馏水稀释0.10mol·L-1的醋酸,c(CH3COO-)/c(CH3COOH)的数值逐渐增大
D.等体积、等pH的CH3COOH与HClO两溶液与NaOH恰好完全反应,CH3COOH消耗氢氧化钠物质的量更多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如图所示:
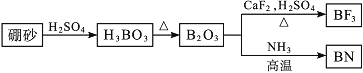
请回答下列问题:
(1)B和N相比,电负性较大的是___,BN中B元素的化合价为___;
(2)在BF3分子中,F—B—F的键角是___;BF3和过量NaF作用可生成NaBF4,BF4-的立体构型为___;
(3)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为___,层间作用力为___,六方相氮化硼晶体层内一个硼原子与相邻氮原子构成的空间构型为___,其结构与石墨相似却不导电,原因是___。
(4)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm。立方氮化硼晶胞中含有___个氮原子、___个硼原子,立方氮化硼的密度是___g·cm-3(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组制备高铁酸钾(K2FeO4)并探究其性质。查阅文献,得到以下资料: K2FeO4为紫色固体,微溶于 KOH 溶液;具有强氧化性,在酸性或中性溶液中快速产生 O2,在碱性溶液中较稳定。
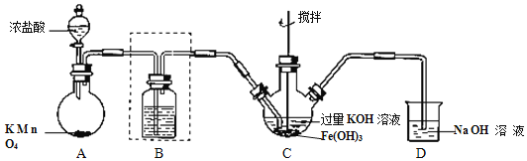
Ⅰ.制备 K2FeO4(夹持装置略)。
(1)A 为氯气的实验室发生装置。A 中反应方程式是______(锰被还原为 Mn2+)。若反应中有 0.5molCl2产生,则电子转移的数目为______。工业制氯气的反应方程式为______。
(2)装置 B 中盛放的试剂是______,简述该装置在制备高铁酸钾中的作用______。
(3)C 中得到紫色固体和溶液。C 中 Cl2发生的反应有:3Cl2+2Fe(OH)3+10KOH→2K2FeO4+6KCl+8H2O,根据该反应方程式得出:碱性条件下,氧化性 Cl2______FeO42-(填“>”或“<”)。另外C中还可能发生其他反应,请用离子方程式表示______。
Ⅱ.探究 K2FeO4 的性质
(4)甲同学取少量 K2FeO4 加入浑浊的泥浆水中,发现产生气体,搅拌,浑浊的泥浆水很快澄清。请简述 K2FeO4的净水原理。______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是工业电解饱和食盐水的装置示意图,下列有关说法中不正确的是( )

A.装置中出口①处的物质是氯气,出口②处的物质是氢气
B.该离子交换膜只能让阳离子通过,不能让阴离子通过
C.装置中发生反应的离子方程式为Cl-+2H+![]() Cl2↑+H2↑
Cl2↑+H2↑
D.该装置是将电能转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,现有氨水和盐酸两溶液。回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中 ________。(增大、减小、不变)
________。(增大、减小、不变)
(2)若向该氨水中加入氢氧化钠固体,则该电离平衡向_________方向移动(分子化、离子化),电离平衡常数______________。(增大、减小或不变)
(3)0.2 mol/L氨水和0.2 mol/L 盐酸溶液与等体积混合,溶液呈_____性 (酸、碱、中) ;其原因用离子方程式表示为__________________。混合液中,c(NH4+)+c(NH3H2O)=_______mol/L。(忽略体积变化)。请根据电荷守恒写出一个用离子浓度表示的等式_____________________。
(4)用0.1000mol/L HCl溶液滴定未知浓度的NaOH溶液,重复三次的实验数据如下所示
序号 | 0.100mol/L HCl溶液体积/mL | 待测NaOH溶液体积/mL |
1 | 27.83 | 25.00 |
2 | 26.53 | 25.00 |
3 | 27.85 | 25.00 |
该滴定可以使用的指示剂是__________;达到滴定终点时的现象是____________________。
待测NaOH溶液的物质的量浓度为_____________mol/L。(保留四位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大运会时深圳新能源汽车上有一种质子交换膜燃料电池,工作原理如图所示,下列叙述正确的是( )
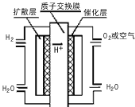
A.通入氧气的电极发生氧化反应
B.通入氢气的电极为正极
C.总反应式为O2+2H2![]() 2H2O
2H2O
D.正极的电极反应式为O2+4H++4e-=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)的平衡常数,下列说法正确的是
Fe3O4(s)+4H2(g)的平衡常数,下列说法正确的是
A.增大H2O(g)的浓度或减小H2的浓度,会使平衡常数减小
B.改变反应的温度,平衡常数不一定变化
C.K=![]()
D.K=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活、社会密切相关,下列说法正确的是
A.利用海水制取氯化钠、烧碱、纯碱、氯气等物质都发生了氧化还原反应
B.蛋白质、葡萄糖、纤维素、油脂等都能在人体内水解并提供能量
C.为了提高生活用水的卫生标准,自来水厂常使用![]() 和
和![]() 进行消毒、净化、以改善水质
进行消毒、净化、以改善水质
D.塑料、合成橡胶和纤维这三大合成材料,都主要以石油、煤和天然气为原料生产的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com