
【题目】大运会时深圳新能源汽车上有一种质子交换膜燃料电池,工作原理如图所示,下列叙述正确的是( )
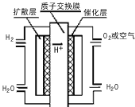
A.通入氧气的电极发生氧化反应
B.通入氢气的电极为正极
C.总反应式为O2+2H2![]() 2H2O
2H2O
D.正极的电极反应式为O2+4H++4e-=2H2O
科目:高中化学 来源: 题型:
【题目】向物质的量各有1mol的NH4Al(SO4)2和H2SO4混合稀溶液中逐滴加入一定量Ba(OH)2溶液,产生沉淀的量随着Ba(OH)2 加入量的变化如图所示。下列离子方程式书写正确的是

A. O→A:H++SO42-+Ba2++OH-=BaSO4↓+H2O
B. A→B:2Al3++3SO42-+3Ba2+ +6OH-=3BaSO4↓+2Al(OH)3↓
C. B→C:NH4++SO42-+Ba2+ +OH-=BaSO4↓+NH3·H2O
D. D→E:NH4++ OH-=NH3·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中,进行铁的电化学腐蚀实验。下列有关该实验的说法正确的是( )

A.在此实验过程中铁元素被还原
B.铁腐蚀过程中化学能全部转化为电能
C.活性炭的存在会加速铁的腐蚀
D.以水代替NaCl溶液,铁不能发生吸氧腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型陶瓷材料氮化硅(Si3N4)可用于制作火箭发动机中燃料的喷嘴。氮化硅可由石英、焦炭在高温氮气流中制取。完成下列填空:______SiO2+______C+______N2![]() ______Si3N4+______CO。
______Si3N4+______CO。
(1)试配平该化学反应方程式,将系数填写在对应位置上。在方程式上标出电子转移的方向和数目。____________
(2)反应中______被还原,当氧化产物比还原产物多 1mol 时,反应中电子转移数为______。
(3)在该反应体系中:所涉及物质属于非极性分子的电子式为______;所涉及元素中原子半径最大的原子的最外层电子排布式为______。
(4)反应的主要产物氮化硅所属的晶体类型为______,证明氮化硅组成元素非金属性强弱:
(Ⅰ)写出一个化学事实______;
(Ⅱ)从原子结构上进行说明:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设 NA 为阿伏加德罗常数的值,下列说法错误的是( )
A.标准状况下,80g SO3 所含的原子数为 4NA
B.过氧化钠与水反应时,生成 0.1molO2 转移的电子数为 0.2NA
C.1mol N2、3mol H2 混合反应,当生成 0.1mol NH3 时,转移电子数目为 0.3NA
D.100mL 0.1molL-1 的 Na2S 溶液,含有的阴离子数目为 0.01NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容容器中发生N2O4(g)2NO2(g),若反应物的浓度由0.1molL﹣1降到0.06molL﹣1需20s,那么由0.06molL﹣1降到0.036molL﹣1,所需反应时间为( )
A. 10 sB. 12 sC. 大于12 sD. 小于12 s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: (1)Fe2O3(s)+![]() C(s)=
C(s)=![]() CO2(g)+2Fe(s),ΔH=+234.1kJmol-1
CO2(g)+2Fe(s),ΔH=+234.1kJmol-1
![]() 则
则![]() 的ΔH是( )
的ΔH是( )
A.-824.4 kJmol-1B.-627.6kJmol-1C.-744.7kJmol-1D.-169.4kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:2H2(g)+O2(g) ![]() 2H2O(l) H= -571.6 kJ·mol-1,2CH3OH(l)+3O2(g)
2H2O(l) H= -571.6 kJ·mol-1,2CH3OH(l)+3O2(g) ![]() 2CO2(g)+4H2O(l) H= -1452 kJ·mol-1,H+(aq)+OH-(aq)
2CO2(g)+4H2O(l) H= -1452 kJ·mol-1,H+(aq)+OH-(aq) ![]() H2O(l) H= -57.3 kJ·mol-1。据此判断下列说法正确的是
H2O(l) H= -57.3 kJ·mol-1。据此判断下列说法正确的是
A. CH3OH的燃烧热为1452 kJ·mol-1
B. 2H2(g)+O2(g) ![]() 2H2O(g) H > -571.6 kJ·mol-1
2H2O(g) H > -571.6 kJ·mol-1
C. CH3COOH(aq)+NaOH(aq) ![]() H2O(l)+CH3COONa(aq) H= -57.3 kJ·mol-1
H2O(l)+CH3COONa(aq) H= -57.3 kJ·mol-1
D. 2CH3OH(l)+O2(g) ![]() 2CO2(g)+4H2(g) H= -880.4 kJ·mol-1
2CO2(g)+4H2(g) H= -880.4 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下的方案。
编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
浓度/ molL-1 | 体积/mL | 浓度/ molL-1 | 体积/mL | ||
① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,每消耗1mol H2C2O4转移_____mol 电子。为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为:c(H2C2O4)∶c(KMnO4) ≥______________。
(2)探究温度对化学反应速率影响的实验编号是___________(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是_____________。
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=_______________ molL-1min-1。
(4)已知50℃时c(MnO4-)~反应时间t的变化曲线如图。若保持其他条件不变,请在答题卡坐标图中,画出25℃时c(MnO4-)~t的变化曲线示意图。
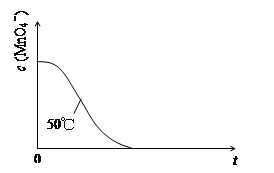 _____________
_____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com