
【题目】已知热化学方程式:2H2(g)+O2(g) ![]() 2H2O(l) H= -571.6 kJ·mol-1,2CH3OH(l)+3O2(g)
2H2O(l) H= -571.6 kJ·mol-1,2CH3OH(l)+3O2(g) ![]() 2CO2(g)+4H2O(l) H= -1452 kJ·mol-1,H+(aq)+OH-(aq)
2CO2(g)+4H2O(l) H= -1452 kJ·mol-1,H+(aq)+OH-(aq) ![]() H2O(l) H= -57.3 kJ·mol-1。据此判断下列说法正确的是
H2O(l) H= -57.3 kJ·mol-1。据此判断下列说法正确的是
A. CH3OH的燃烧热为1452 kJ·mol-1
B. 2H2(g)+O2(g) ![]() 2H2O(g) H > -571.6 kJ·mol-1
2H2O(g) H > -571.6 kJ·mol-1
C. CH3COOH(aq)+NaOH(aq) ![]() H2O(l)+CH3COONa(aq) H= -57.3 kJ·mol-1
H2O(l)+CH3COONa(aq) H= -57.3 kJ·mol-1
D. 2CH3OH(l)+O2(g) ![]() 2CO2(g)+4H2(g) H= -880.4 kJ·mol-1
2CO2(g)+4H2(g) H= -880.4 kJ·mol-1
【答案】B
【解析】A.根据方程式2CH3OH(l)+3O2(g) =2CO2(g)+4H2O(l) H= -1452 kJ·mol-1可知,CH3OH的燃烧热为![]() ×1452 kJ·mol-1=726 kJ·mol-1,故A错误;B.液态水变成水蒸气会吸热,因此2H2(g)+O2(g) =2H2O(g) H > -571.6 kJ·mol-1,故B正确;C. 醋酸为弱酸,电离需要吸热,CH3COOH(aq)+NaOH(aq) =H2O(l)+CH3COONa(aq) H>-57.3 kJ·mol-1,故C错误;D. ①2H2(g)+O2(g) =2H2O(l) H= -571.6 kJ·mol-1,②2CH3OH(l)+3O2(g) =2CO2(g)+4H2O(l) H= -1452 kJ·mol-1,根据盖斯定律,将②-①×2得:2CH3OH(l)+O2(g) =2CO2(g)+4H2(g) H= -308.8 kJ·mol-1,故D错误;故选B。
×1452 kJ·mol-1=726 kJ·mol-1,故A错误;B.液态水变成水蒸气会吸热,因此2H2(g)+O2(g) =2H2O(g) H > -571.6 kJ·mol-1,故B正确;C. 醋酸为弱酸,电离需要吸热,CH3COOH(aq)+NaOH(aq) =H2O(l)+CH3COONa(aq) H>-57.3 kJ·mol-1,故C错误;D. ①2H2(g)+O2(g) =2H2O(l) H= -571.6 kJ·mol-1,②2CH3OH(l)+3O2(g) =2CO2(g)+4H2O(l) H= -1452 kJ·mol-1,根据盖斯定律,将②-①×2得:2CH3OH(l)+O2(g) =2CO2(g)+4H2(g) H= -308.8 kJ·mol-1,故D错误;故选B。


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】从海水中提取部分物质的过程如下图所示,下列有关说法错误的是
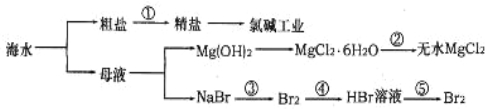
A.过程①需要加入化学试剂、沉淀、过滤等操作
B.由“母液→无水MgCl2”一系列变化中未涉及氧化还原反应
C.工业上一般用电解氯化镁溶液制取Mg单质
D.反应③和⑤均可由下列反应实现:2Br-+Cl2=Br2+2Cl-,该反应属于置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。下图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法正确的是( )
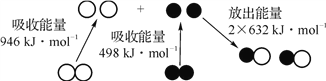
A. 放电条件下,N2(g)和O2(g)混合能直接化合生成NO(g)
B. NO是一种酸性氧化物,能用NaOH溶液处理含NO的尾气
C. N2(g)和O2(g)反应生成 NO(g),相当于N2(g)在O2(g)燃烧,该反应放热
D. 28 g N2(g)和32 g O2(g)完全反应生成 NO(g),放出的能量为180 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙![]() 难溶于水,在常温下稳定,在潮湿空气及水中缓慢分解放出氧气,因而广泛应用于渔业、农业、环保等许多方面。下图是以大理石
难溶于水,在常温下稳定,在潮湿空气及水中缓慢分解放出氧气,因而广泛应用于渔业、农业、环保等许多方面。下图是以大理石![]() 主要杂质是氧化铁
主要杂质是氧化铁![]() 等为原料制取过氧化钙
等为原料制取过氧化钙![]() 的流程。
的流程。
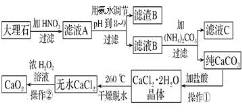
请回答下列问题:
![]() 操作
操作![]() 应包括下列操作中的________。
应包括下列操作中的________。![]() 填序号
填序号![]()
A 溶解 ![]() 过滤
过滤 ![]() 蒸馏
蒸馏 ![]() 分液
分液 ![]() 蒸发结晶
蒸发结晶
![]() 用氨水调节pH至
用氨水调节pH至![]() 的目的是________。
的目的是________。
![]() 若测得滤液C中
若测得滤液C中![]() ,则
,则![]() ________
________![]() 填“是”或“不”
填“是”或“不”![]() 沉淀完全。
沉淀完全。![]() 已知
已知![]() 时即可视为沉淀完全;
时即可视为沉淀完全;![]()
![]() 若在滤液C中,加入
若在滤液C中,加入![]() 使溶液呈酸性以得到副产物
使溶液呈酸性以得到副产物![]() ,则酸化后溶液中
,则酸化后溶液中![]() ____________
____________![]() 填“
填“![]() ”、“
”、“![]() ”、“
”、“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() 。
。
![]() 操作
操作![]() 是:在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,一段时间后,再加入氢氧化钠溶液,当调节溶液pH至
是:在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,一段时间后,再加入氢氧化钠溶液,当调节溶液pH至![]() ,才出现大量沉淀。写出该反应的化学方程式________;用简要的文字解释用氢氧化钠调节pH至
,才出现大量沉淀。写出该反应的化学方程式________;用简要的文字解释用氢氧化钠调节pH至![]() 的原因_________。
的原因_________。
![]() 已知大理石含
已知大理石含![]() 的质量分数为a,
的质量分数为a,![]() 大理石可以制得
大理石可以制得![]() ,请计算:
,请计算:![]() 转化为
转化为![]() 过程中,Ca原子的利用率________。
过程中,Ca原子的利用率________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2催化加氢制取甲醇、乙醇等低碳醇的研究,对于环境问题和能源问题都具有非常重要的意义。已知一定条件下的如下反应:
CO2(g) + 3H2(g) ![]() CH3OH(g) + H2O(g) H =-49.0 kJ· mol-1
CH3OH(g) + H2O(g) H =-49.0 kJ· mol-1
2CO2(g) + 6H2(g) ![]() CH3CH2OH(g) + 3H2O(g) H=-173.6 kJ· mol-1
CH3CH2OH(g) + 3H2O(g) H=-173.6 kJ· mol-1
下列说法不正确的是
A.CH3OH(g) + CO2(g) + 3H2(g) ![]() CH3CH2OH(g) + 2H2O(g) H<0
CH3CH2OH(g) + 2H2O(g) H<0
B.增大压强,有利于反应向生成低碳醇的方向移动,平衡常数增大
C.升高温度,可以加快生成低碳醇的速率,但反应限度降低
D.增大氢气浓度可以提高二氧化碳的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2 mol SO2和2 mol SO3气体混合于某固定体积的密闭容器中,在一定条件下反应:2SO2(g)+O2(g)![]() 2SO3(g),平衡时SO3为W mol。相同温度下,分别按下列配比在相同体积的容器中反应,反应达到平衡时,SO3的物质的量大于W mol的是( )
2SO3(g),平衡时SO3为W mol。相同温度下,分别按下列配比在相同体积的容器中反应,反应达到平衡时,SO3的物质的量大于W mol的是( )
A.2 mol SO2+1 mol O2B.4 mol SO2+1 mol O2
C.2 mol SO2+1 mol O2+2 mol SO3D.3 mol SO2+1 mol SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知苯甲酸的酸性比碳酸强,苯酚的酸性比碳酸弱。则可将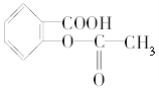 转变为
转变为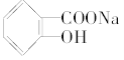 的方法是( )
的方法是( )
①与足量的NaOH溶液共热,再通入CO2 ②与稀硫酸共热后,加入足量的NaOH溶液 ③加热溶液,通入足量的SO2 ④与稀H2SO4共热后,加入足量的NaHCO3
A.①②
B.①④
C.②③
D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
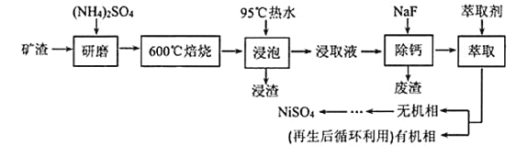
【题目】铁、镍及其化合物在工业上有广泛的应用。从某矿渣 ![]() 成分为
成分为![]() 铁酸镍
铁酸镍![]() 、NiO、FeO、CaO、
、NiO、FeO、CaO、![]() 等
等![]() 中回收
中回收![]() 的工艺流程如下:
的工艺流程如下:
已知![]() 在
在![]() 分解生成
分解生成![]() 和
和![]() ,回答下列问题:
,回答下列问题:
![]() “浸渣”的成分有
“浸渣”的成分有![]() 、
、![]() 、
、![]() 外,还含有_________
外,还含有_________![]() 写化学式
写化学式![]() 。
。
![]() 矿渣中部分FeO焙烧时与
矿渣中部分FeO焙烧时与![]() 反应生成
反应生成![]() 的化学方程式为_____________。
的化学方程式为_____________。
![]() 溶剂萃取可用于对溶液中的金属离子进行富集与分离:
溶剂萃取可用于对溶液中的金属离子进行富集与分离:![]() 水相
水相![]() 有机相
有机相![]() 有机相
有机相![]() 水相
水相![]() 。萃取剂与溶液的体积比
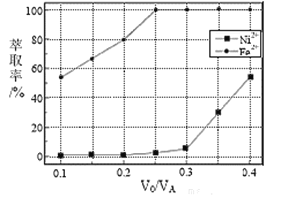
。萃取剂与溶液的体积比![]() 对溶液中
对溶液中![]() 、
、![]() 的萃取率影响如下图所示,
的萃取率影响如下图所示,![]() 的最佳取值为________。在_______
的最佳取值为________。在_______![]() 填“强碱性”“强酸性”或“中性”
填“强碱性”“强酸性”或“中性”![]() 介质中“反萃取”能使有机相再生而循环利用。
介质中“反萃取”能使有机相再生而循环利用。
![]() 以Fe、Ni为电极制取
以Fe、Ni为电极制取![]() 的原理如下图所示。通电后,在铁电极附近生成紫红色的
的原理如下图所示。通电后,在铁电极附近生成紫红色的![]() ,若pH过高,铁电极区会产生红褐色物质。
,若pH过高,铁电极区会产生红褐色物质。
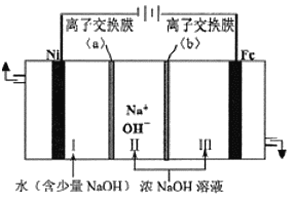
![]() 电解时阳极的电极反应式为_________,离子交换膜
电解时阳极的电极反应式为_________,离子交换膜![]() 为________
为________![]() 填“阴”或“阳
填“阴”或“阳![]() 离子交换膜。
离子交换膜。
![]() 向铁电极区出现的红褐色物质中加入少量的NaClO溶液,沉淀溶解。该反应的离子方程式为__________。
向铁电极区出现的红褐色物质中加入少量的NaClO溶液,沉淀溶解。该反应的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列给定条件的溶液中,一定能大量共存的离子组是( )
A.无色溶液:Ca2+、H+、Cl-、HSO3-
B.能使pH试纸呈红色的溶液:Na+、NO3-、I-、AlO2-
C.FeCl3溶液:K+、Na+、Fe2+、S2-
D.![]() =0.1 molL-1的溶液:Na+、K+、SiO32-、NO3-
=0.1 molL-1的溶液:Na+、K+、SiO32-、NO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com