
����Ŀ����������![]() ������ˮ���ڳ������ȶ����ڳ�ʪ������ˮ�л����ֽ�ų�����������㷺Ӧ������ҵ��ũҵ������������档��ͼ���Դ���ʯ
������ˮ���ڳ������ȶ����ڳ�ʪ������ˮ�л����ֽ�ų�����������㷺Ӧ������ҵ��ũҵ������������档��ͼ���Դ���ʯ![]() ��Ҫ������������
��Ҫ������������![]() ��Ϊԭ����ȡ��������
��Ϊԭ����ȡ��������![]() �����̡�
�����̡�
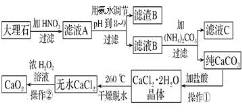
��ش��������⣺
![]() ����
����![]() Ӧ�������в����е�________��
Ӧ�������в����е�________��![]() �����
�����![]()
A �ܽ� ![]() ����
���� ![]() ����
���� ![]() ��Һ
��Һ ![]() �����ᾧ
�����ᾧ
![]() �ð�ˮ����pH��
�ð�ˮ����pH��![]() ��Ŀ����________��
��Ŀ����________��
![]() �������ҺC��
�������ҺC��![]() ����
����![]() ________
________![]() ����������������
����������������![]() ������ȫ��
������ȫ��![]() ��֪
��֪![]() ʱ������Ϊ������ȫ��
ʱ������Ϊ������ȫ��![]()
![]() ������ҺC�У�����
������ҺC�У�����![]() ʹ��Һ�������Եõ�������
ʹ��Һ�������Եõ�������![]() �����ữ����Һ��
�����ữ����Һ��![]() ____________
____________![]() ����
����![]() ������
������![]() ������
������![]() ������
������![]() ������
������![]() ��
��![]() ��
��
![]() ����
����![]() �ǣ��ڵ����£�����������Ũ��Һ��Ͷ����ˮ�Ȼ��ƽ��з�Ӧ��һ��ʱ����ټ�������������Һ����������ҺpH��
�ǣ��ڵ����£�����������Ũ��Һ��Ͷ����ˮ�Ȼ��ƽ��з�Ӧ��һ��ʱ����ټ�������������Һ����������ҺpH��![]() ���ų��ִ���������д���÷�Ӧ�Ļ�ѧ����ʽ________���ü�Ҫ�����ֽ������������Ƶ���pH��
���ų��ִ���������д���÷�Ӧ�Ļ�ѧ����ʽ________���ü�Ҫ�����ֽ������������Ƶ���pH��![]() ��ԭ��_________��
��ԭ��_________��
![]() ��֪����ʯ��
��֪����ʯ��![]() ����������Ϊa��
����������Ϊa��![]() ����ʯ�����Ƶ�
����ʯ�����Ƶ�![]() ������㣺
������㣺![]() ת��Ϊ
ת��Ϊ![]() �����У�Caԭ�ӵ�������________��
�����У�Caԭ�ӵ�������________��
���𰸡�![]() ��ȥ
��ȥ![]() ��
�� ![]()
![]() ��
��![]() ����NaOH��Һʹ����ƽ��������Ӧ�����ƶ���������
����NaOH��Һʹ����ƽ��������Ӧ�����ƶ���������![]() ����������
���������� ![]()
��������
����ͼʾ��Ϣ���ɵó�����ҺA�ijɷ�������ƺ��������Լ�ʣ������ᣬ��pH��8-9��Χ����ʱ�������������γɳ�������������B��������������ҺB������ƣ���̼���֮����Է������ֽⷴӦ����̼��ƺ�����泥����ˣ�����̼����������ܽ�Ȼ�������ᾧ���Եõ��Ȼ��ƾ��壬��ʧˮ��Ϊ��ˮ�Ȼ��ƣ�˫��ˮ���Ժ��Ȼ��Ʒ�Ӧ���ɹ������ƺ����ᡣ
��1����̼����м����ᣬ�������ܽ⣬Ȼ������Ũ������ȴ�ᾧ�����˿ɵ�CaCl2.2H2O���ʰ���ABE��
��2�������ʯ(��Ҫ������������)�м������ᣬ��ҺA�к�����Fe3+�����백ˮ��Fe3+ת��ΪFe(OH)3����ȥ��
��3��c(Ca2��)=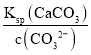 =
=![]() ��10��5mol/L����Ca2���ѳ�����ȫ��
��10��5mol/L����Ca2���ѳ�����ȫ��
��4��NH4NO3��Һ�У�NH4+ˮ����Һ�����ԣ�����c(NH![]() )��c(NO
)��c(NO![]() )��
)��
��5���������֪����ѧ����ʽΪCaCl2��H2O2![]() CaO2��2HCl(��CaCl2��H2O2��2NaOH=CaO2����2NaCl��2H2O)�����������Ƶ���pH��9��11��ԭ���ǣ�CaCl2��H2O2
CaO2��2HCl(��CaCl2��H2O2��2NaOH=CaO2����2NaCl��2H2O)�����������Ƶ���pH��9��11��ԭ���ǣ�CaCl2��H2O2![]() CaO2��2HCl������NaOH��Һʹ����ƽ��������Ӧ�����ƶ���������CaO2���������ɣ�
CaO2��2HCl������NaOH��Һʹ����ƽ��������Ӧ�����ƶ���������CaO2���������ɣ�
��6�����ݸ��غ�ɵù�ϵʽ��CaCO3~CaO2����Caԭ�ӵ�������Ϊ��![]() =
=![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ����з������з�ӦaA(g)![]() cC(g)��dD(g)����Ӧ�ﵽƽ����������ѹ����ԭ����һ�룬���ٴδﵽƽ��ʱ��D��Ũ��Ϊԭƽ���1.8��������������ȷ����
cC(g)��dD(g)����Ӧ�ﵽƽ����������ѹ����ԭ����һ�룬���ٴδﵽƽ��ʱ��D��Ũ��Ϊԭƽ���1.8��������������ȷ����
A. A��ת���ʱ��B. ƽ��������Ӧ�����ƶ�
C. D������������D. a��c��d
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������������������������Ҫ�����á��ش��������⣺
(1)��֪4NH3(g)+5O2(g)=4NO(g)+6H2O(g)��H1=��alkJ/mol��4NH3(g)+6NO(g)=5N2(g)+6H2O(g)��H2=��bkJ/mol��H2O(1)=H2O(g)��H3=+ckJ/mol��д����298Kʱ������ȼ������N2���Ȼ�ѧ����ʽ___________��
(2)�����еļ��쵰��(Mb)����O2�������MbO2��Mb(aq)+O2(g)![]() MbO2(aq)������k����k���ֱ��ʾ����Ӧ���淴Ӧ�����ʳ�������V��=k����c(Mb)��P(O2)��V��=k����c(MbO2)��37��ʱ��ü��쵰�Ľ�϶�(��)��P(O2)�Ĺ�ϵ���±�[��϶�(��)ָ����O2��ϵļ��쵰��ռ�ܼ��쵰�İٷֱ�]��
MbO2(aq)������k����k���ֱ��ʾ����Ӧ���淴Ӧ�����ʳ�������V��=k����c(Mb)��P(O2)��V��=k����c(MbO2)��37��ʱ��ü��쵰�Ľ�϶�(��)��P(O2)�Ĺ�ϵ���±�[��϶�(��)ָ����O2��ϵļ��쵰��ռ�ܼ��쵰�İٷֱ�]��
P(O2) | 0.50 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 | 6.00 |
����MbO2%�� | 50.0 | 67.0 | 80.0 | 85.0 | 88.0 | 90.3 | 91.0 |
�ټ���37�桢P(O2)Ϊ2.00kPaʱ��������Ӧ��ƽ�ⳣ��K=___________��
�ڵ���ƽ��ʱ���쵰����O2�Ľ�϶�(��)��O2��ѹǿ[P(O2)]֮��Ĺ�ϵʽ��=___________(�ú���k����k����ʽ�ӱ�ʾ)��
(3)���ɼ��쵰�ĸʰ���(NH2CH2COOH)��һ���������ʣ�����Һ��������������ʽ���ڣ���ת����ϵ���£�
![]()
![]()
![]()
![]()
![]()
�ڸʰ�����Һ�м�������������ӵİٷֺ�����![]() �Ĺ�ϵ��ͼ��ʾ��
�Ĺ�ϵ��ͼ��ʾ��

�ٴ��ʰ�����Һ��___________�ԣ�����Һ������ʱ�������ӵ�Ũ���ɴ�С��˳��Ϊ___________��
����![]() =8����Һ�м������HClʱ����Ӧ�����ӷ���ʽΪ___________��
=8����Һ�м������HClʱ����Ӧ�����ӷ���ʽΪ___________��
���õ�λ�ζ����ɲⶨij�ʰ�����Ʒ�Ĵ���.

��ȡ��Ʒ150mg����һ�������£���0.1000mol/L�ĸ�������Һ�ζ�(��ʰ���1�U1������Ӧ)����õ�ѹ�仯�����HClO4��Һ�������ϵ����ͼ�����հ���ʵ�飬����HClO4��Һ�����Ϊ0.25mL������Ʒ�Ĵ���Ϊ___________%(����������һλС��)

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ý���ͭ��ȡ����ͭ���ӽ�Լԭ�Ϻͷ�ֹ������Ⱦ���濼�ǣ���õķ�����( )
A.![]()
B.![]()
C.![]()
D.![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л�������A�ķ���ʽ��C13H20O8����Է�������Ϊ304��,1molA��������������4mol![]() ��Ӧ�õ�4molCH2COOH��1molB.����˵���������
��Ӧ�õ�4molCH2COOH��1molB.����˵���������
A. A��B����Է�������֮��Ϊ168
B. Bһ�����ܷ����ӳɷ�Ӧ
C. �л���B��CH3CH2OH��Ϊͬϵ��
D. ����ʽΪC5H1002����CH2COOH����ͬ�����ʵ��л���ֻ��4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����л���ײ���FJI-H14�ڳ��³�ѹ�¶�CO2���г��ߵ��������������ܸ�Ч��CO2�뻷������������ķ�Ӧ���乤��ԭ����ͼ��ʾ������˵������ȷ���ǣ� ��
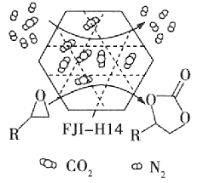
A.�ò��ϵ��������þ���ѡ����
B.�÷����Ĺ㷺ʹ�������ڼ���CO2�ŷ�
C.������ �Ĺ����У��м��Թ��ۼ��γ�
�Ĺ����У��м��Թ��ۼ��γ�
D.�乤��ԭ��ֻ�漰��ѧ�仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�Ȼ�ѧ����ʽ��2H2(g)+O2(g) ![]() 2H2O(l) H= -571.6 kJ��mol-1��2CH3OH(l)+3O2(g)
2H2O(l) H= -571.6 kJ��mol-1��2CH3OH(l)+3O2(g) ![]() 2CO2(g)+4H2O(l) H= -1452 kJ��mol-1��H+(aq)+OH��(aq)
2CO2(g)+4H2O(l) H= -1452 kJ��mol-1��H+(aq)+OH��(aq) ![]() H2O(l) H= -57.3 kJ��mol-1���ݴ��ж�����˵����ȷ����
H2O(l) H= -57.3 kJ��mol-1���ݴ��ж�����˵����ȷ����
A. CH3OH��ȼ����Ϊ1452 kJ��mol-1
B. 2H2(g)+O2(g) ![]() 2H2O(g) H > -571.6 kJ��mol-1
2H2O(g) H > -571.6 kJ��mol-1
C. CH3COOH(aq)+NaOH(aq) ![]() H2O(l)+CH3COONa(aq) H= -57.3 kJ��mol-1
H2O(l)+CH3COONa(aq) H= -57.3 kJ��mol-1
D. 2CH3OH(l)+O2(g) ![]() 2CO2(g)+4H2(g) H= -880.4 kJ��mol-1
2CO2(g)+4H2(g) H= -880.4 kJ��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ð֢״�IJ���ҵĽṹ��ʽ��ͼ��ʾ�������й�˵������ȷ���ǣ� ��
![]()
A.1mol�������������NaHCO3��Һ��Ӧ�������1molCO2
B.����ҵķ���ʽΪC13H18O2
C.����ұ����ϵ�һ�������2��
D.������뱽���������ͬϵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�Ǽ�ͬѧ��Ƶ�֤��CO���л�ԭ�Ե�ʵ��װ�á��ش��������⣺
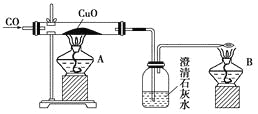
(1)ʵ��ʱӦ�ȵ�ȼ________(����A������B��)���ľƾ��ơ�
(2)ϴ��ƿ�е�����Ϊ__________________________________________________________��
(3)�ƾ���B��������_________________________________________________________��
(4)��ͬѧ��������̫���ӣ��ɽ��ƾ��ƺ϶�Ϊһ��ȥ��B����β�����ܿ���ת��A�Ļ����ϼ��ɣ���ͬѧ����Ƿ������________��������______________________________��
(5)��ͬѧ����CO�ܷ�ʹʯ��ˮ����ǣ�����������COͨ��CuO֮ǰӦ��ͨ������ʯ��ˮ���ų�CO�����ʯ��ˮ��Ӧ���ԶԴ��������ۣ�����Ϊ�������________(������Ҫ����������Ҫ��)��������____________________________________________��
(6)��ͬѧ��Ϊ����Ƶ�װ����β����������������������������Ϊ��ͬѧ���һ�ֺ�����β������������________________________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com