
【题目】如图是甲同学设计的证明CO具有还原性的实验装置。回答下列问题:
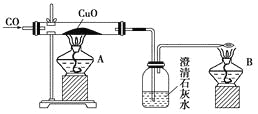
(1)实验时应先点燃________(填“A”或“B”)处的酒精灯。
(2)洗气瓶中的现象为__________________________________________________________。
(3)酒精灯B的作用是_________________________________________________________。
(4)乙同学提出甲设计太复杂,可将酒精灯合二为一,去掉B而将尾气导管口旋转到A的火焰上即可,乙同学设计是否合理?________;理由是______________________________。
(5)丙同学质疑CO能否使石灰水变浑浊,因此其设计在CO通入CuO之前应先通过澄清石灰水以排除CO与澄清石灰水反应,试对此做出评价,你认为丙的设计________(填“必要”或“不必要”),理由是____________________________________________。
(6)丁同学认为甲设计的装置中尾气处理还可以用其他方法,请你为丁同学设计一种合理的尾气处理方法:________________________________________。
【答案】B 澄清石灰水变浑浊 将未反应的CO转化为CO2,防止污染空气 不合理 A、B并非同时点燃 不必要 在点燃A之前CO已通过石灰水 在导管末端连接一气囊(或贮气瓶)再处理
【解析】
证明CO具有还原性,可将CO通过氧化铜,黑色的氧化铜变红,其后的石灰水变浑浊,即可证明CO把氧化铜还原成了铜,本身被氧化为CO2,使石灰水变浑浊,证明了CO的还原性。未反应的CO要用点燃的方法除去,以免污染空气。
(1) 由于CO是可燃性气体,与空气混合加热可能发生爆炸,因此与CuO反应前,应先通入CO排除装置中的空气,CO有毒,故应先点燃B处酒精灯进行处理。
(2)CO被氧化为CO2,CO2能使石灰水变浑浊。
(3)酒精灯B的作用是将未反应的CO转化为CO2,防止污染空气。
(4)实验时要先点燃B处的酒精灯,后点燃A处的酒精灯,不可将酒精灯合二为一。
(5) 在反应前CO已通过石灰水,没必要再设计CO与石灰水的反应。
(6)CO还可以用气囊储存,故可在导管末端连接一气囊(或贮气瓶)再处理。


科目:高中化学 来源: 题型:
【题目】过氧化钙![]() 难溶于水,在常温下稳定,在潮湿空气及水中缓慢分解放出氧气,因而广泛应用于渔业、农业、环保等许多方面。下图是以大理石
难溶于水,在常温下稳定,在潮湿空气及水中缓慢分解放出氧气,因而广泛应用于渔业、农业、环保等许多方面。下图是以大理石![]() 主要杂质是氧化铁
主要杂质是氧化铁![]() 等为原料制取过氧化钙
等为原料制取过氧化钙![]() 的流程。
的流程。
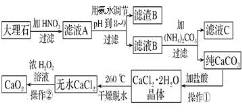
请回答下列问题:
![]() 操作
操作![]() 应包括下列操作中的________。
应包括下列操作中的________。![]() 填序号
填序号![]()
A 溶解 ![]() 过滤
过滤 ![]() 蒸馏
蒸馏 ![]() 分液
分液 ![]() 蒸发结晶
蒸发结晶
![]() 用氨水调节pH至
用氨水调节pH至![]() 的目的是________。
的目的是________。
![]() 若测得滤液C中
若测得滤液C中![]() ,则
,则![]() ________
________![]() 填“是”或“不”
填“是”或“不”![]() 沉淀完全。
沉淀完全。![]() 已知
已知![]() 时即可视为沉淀完全;
时即可视为沉淀完全;![]()
![]() 若在滤液C中,加入
若在滤液C中,加入![]() 使溶液呈酸性以得到副产物
使溶液呈酸性以得到副产物![]() ,则酸化后溶液中
,则酸化后溶液中![]() ____________
____________![]() 填“
填“![]() ”、“
”、“![]() ”、“
”、“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() 。
。
![]() 操作
操作![]() 是:在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,一段时间后,再加入氢氧化钠溶液,当调节溶液pH至
是:在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,一段时间后,再加入氢氧化钠溶液,当调节溶液pH至![]() ,才出现大量沉淀。写出该反应的化学方程式________;用简要的文字解释用氢氧化钠调节pH至
,才出现大量沉淀。写出该反应的化学方程式________;用简要的文字解释用氢氧化钠调节pH至![]() 的原因_________。
的原因_________。
![]() 已知大理石含
已知大理石含![]() 的质量分数为a,
的质量分数为a,![]() 大理石可以制得
大理石可以制得![]() ,请计算:
,请计算:![]() 转化为
转化为![]() 过程中,Ca原子的利用率________。
过程中,Ca原子的利用率________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、镍及其化合物在工业上有广泛的应用。从某矿渣 ![]() 成分为
成分为![]() 铁酸镍
铁酸镍![]() 、NiO、FeO、CaO、
、NiO、FeO、CaO、![]() 等
等![]() 中回收
中回收![]() 的工艺流程如下:
的工艺流程如下:
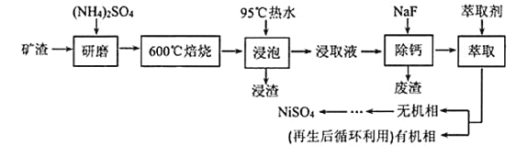
已知![]() 在
在![]() 分解生成
分解生成![]() 和
和![]() ,回答下列问题:
,回答下列问题:
![]() “浸渣”的成分有
“浸渣”的成分有![]() 、
、![]() 、
、![]() 外,还含有_________
外,还含有_________![]() 写化学式
写化学式![]() 。
。
![]() 矿渣中部分FeO焙烧时与
矿渣中部分FeO焙烧时与![]() 反应生成
反应生成![]() 的化学方程式为_____________。
的化学方程式为_____________。
![]() 溶剂萃取可用于对溶液中的金属离子进行富集与分离:
溶剂萃取可用于对溶液中的金属离子进行富集与分离:![]() 水相
水相![]() 有机相
有机相![]() 有机相
有机相![]() 水相
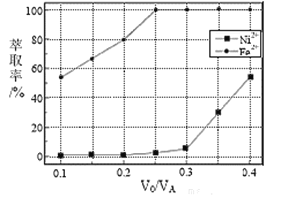
水相![]() 。萃取剂与溶液的体积比
。萃取剂与溶液的体积比![]() 对溶液中
对溶液中![]() 、
、![]() 的萃取率影响如下图所示,
的萃取率影响如下图所示,![]() 的最佳取值为________。在_______
的最佳取值为________。在_______![]() 填“强碱性”“强酸性”或“中性”
填“强碱性”“强酸性”或“中性”![]() 介质中“反萃取”能使有机相再生而循环利用。
介质中“反萃取”能使有机相再生而循环利用。
![]() 以Fe、Ni为电极制取
以Fe、Ni为电极制取![]() 的原理如下图所示。通电后,在铁电极附近生成紫红色的
的原理如下图所示。通电后,在铁电极附近生成紫红色的![]() ,若pH过高,铁电极区会产生红褐色物质。
,若pH过高,铁电极区会产生红褐色物质。
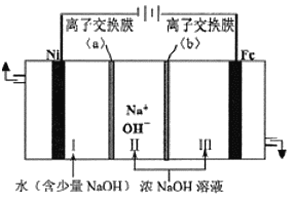
![]() 电解时阳极的电极反应式为_________,离子交换膜
电解时阳极的电极反应式为_________,离子交换膜![]() 为________
为________![]() 填“阴”或“阳
填“阴”或“阳![]() 离子交换膜。
离子交换膜。
![]() 向铁电极区出现的红褐色物质中加入少量的NaClO溶液,沉淀溶解。该反应的离子方程式为__________。
向铁电极区出现的红褐色物质中加入少量的NaClO溶液,沉淀溶解。该反应的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(8分)糖类、油脂和蛋白质都是生命中重要的有机物质。
(1)淀粉在硫酸作用下发生水解反应,检验淀粉水解后生成葡萄糖所需的试剂为 。
(2)最近,在韩国出现中东呼吸综合征疫情,防疫人员用84消毒液对地铁进行消毒,这是利用了蛋白质的性质: (填序号):A.两性,B.水解,C.变性,D.盐析。
(3)某油脂A的结构简式为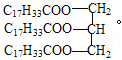 。从酯的性质看,油脂A在酸性条件下和碱性条
。从酯的性质看,油脂A在酸性条件下和碱性条
件下均能发生水解,水解的共同产物是 (写结构简式)。
(4)聚丙烯酸钠、涤纶的结构简式如下:
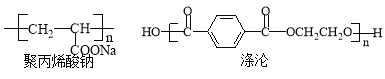
合成聚丙烯酸钠的单体的结构简式是 ,反应类型是 ;
合成涤纶有两种单体,其中能和NaHCO3反应的单体的结构简式是 ,其核磁共振氢谱的峰面积比是 ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“海绵镍铝催化剂” 是一种多孔的镍铝合金,常用作有机催化剂。现以某粗镍(含Ni、Fe、Cu及难与酸、碱溶液反应的不溶性杂质)为原料制取该催化剂,主要流程如下:

己知:25℃时,以0.1mol/L金属离子测定得到如下数据:
物质 | CuS | Cu(OH)2 | Ni(OH)2 | NiS | Fe(OH)3 | |
Ksp | 6×10-36 | 3×10-19 | ||||
pH | 开始沉淀 | 4.7 | 7.2 | 1.9 | ||
沉淀完全 | 6.7 | 9.2 | 3.2 | |||
根据信息回答:
(1)步骤①常用热浓硫酸进行酸浸,写出酸浸时金属镍发生反应的化学方程式__________。
(2)酸浸过程应控制酸的浓度、温度等条件,如图是镍的浸出率与温度的关系,温度高于100℃时,Ni2+浸出率降低的原因可能是______________。

(3)滤液l中含有0.8mol/LNi2+、0.1mol/LFe3+、0.1mol/LCu2+,步骤②的连续操作过程需要先分离出铁元素、铜元素,再制得镍硫化合物。为达到此目的,应先加NaOH将溶液调节至_______(填pH的取值范围);再加_______(选填最佳试剂的序号)。当溶液中Ni2+开始形成NiS时,c(Cu2+)_______。(忽略溶液体积变化)
A.硝酸 B.氨水 C. A12S3 D.H2S
(4)步骤③生成的Ni(CO)4中碳的化合价与KCN中碳的化合价相同,则Ni(CO)4中Ni的化合价为______;工业上也常用NaClO氧化NiSO4,将制得的NiOOH热分解后进行还原得到Ni。ClO-在碱性条件下氧化Ni2+生成NiOOH的离子方程式为_____________。
(5)步骤⑥的目的是降低铝含量、获得多孔状的“海绵镍铝催化剂”,从而增强对氢气的吸附性,步骤⑥的离子方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用如图所示装置制备一硝基甲苯(包括对硝基甲苯和邻硝基甲苯),反应原理: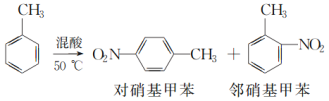
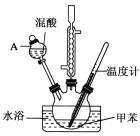
实验步骤:①浓硝酸与浓硫酸按体积比1:3配制混合溶液(即混酸)共40mL;
②在三颈烧瓶中加入13g甲苯(易挥发),按图所示装好药品和其他仪器;
③向三颈烧瓶中加入混酸;
④控制温度约为50~55℃,反应大约10min,三颈烧瓶底部有大量淡黄色油状液体出现;
⑤分离出一硝基甲苯,经提纯最终得到对硝基甲苯和邻硝基甲苯共15g。
相关物质的性质如下:
有机物 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 |
甲苯 | 0.866 | 110.6 | 不溶于水 |
对硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
邻硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液态烃 |
(1)A的仪器名称是___。
(2)水浴加热的优点是__。
(3)配制混酸的方法是__。
(4)若实验后在三颈烧瓶中收集的产物较少,可能的原因是__。
(5)分离反应后产物的方案如下:
混合液![]()
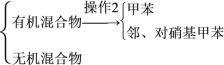
操作1的名称是__,操作2中不需要用到下列仪器中的__(填序号)。
a.冷凝管 b.酒精灯 c.温度计 d.分液漏斗 e.蒸发皿
(6)本实验中邻、对硝基甲苯的产率为__(结果保留至小数点后一位数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列给定条件的溶液中,一定能大量共存的离子组是( )
A.无色溶液:Ca2+、H+、Cl-、HSO3-
B.能使pH试纸呈红色的溶液:Na+、NO3-、I-、AlO2-
C.FeCl3溶液:K+、Na+、Fe2+、S2-
D.![]() =0.1 molL-1的溶液:Na+、K+、SiO32-、NO3-
=0.1 molL-1的溶液:Na+、K+、SiO32-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国具有光辉灿烂的古代科技,早在商代就已经铸造出司母戊大方鼎。回答下列问题:
(1)Cu在元素周期表中的位置___,Cu2+的价电子排布式为__。
(2)已知基态铜的部分电离能如表所示:
电离能/kJ·mol-1 | I1 | I2 | I3 |
Cu | 746 | 1958 | 2058 |
由表格数据知,I2(Cu)远远大于I1(Cu),其原因是__。
(3)Cu2+能与吡咯(![]() )的阴离子(
)的阴离子(![]() )形成双吡咯铜。
)形成双吡咯铜。
①![]() 中C和N原子的杂化均为__,1mol
中C和N原子的杂化均为__,1mol![]() 含有__molσ键;
含有__molσ键;
②双吡咯铜Cu(![]() )2的配位原子为__;
)2的配位原子为__;![]() 噻吩的沸点为84℃,吡咯(
噻吩的沸点为84℃,吡咯(![]() )的沸点在129~131℃之间,吡咯沸点较高,其原因是__。
)的沸点在129~131℃之间,吡咯沸点较高,其原因是__。
(4)某M原子的外围电子排布式为3s23p5,铜与M形成化合物的晶胞如图所示(白球代表M原子)。每个铜原子周围距离最近的铜原子数目__;该晶体的化学式为__。已知该晶体的密度为ρg·cm-3,晶体的摩尔质量为Mg/mol,阿伏伽德罗常数的值为NA,则该晶体中铜原子和M原子之间的最短距离为__pm(只写计算式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】置换反应可以用如图表示,下列有关置换反应的说法错误的是
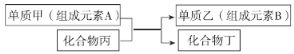
A.若乙是一种常见半导体材料,工业上利用上述反应制取乙的化学方程式为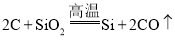
![]()
B.若甲是铝,丙是![]() ,过量的甲与丙反应后,可加入足量的NaOH溶液充分反应后,过滤,将产物乙分离出来
,过量的甲与丙反应后,可加入足量的NaOH溶液充分反应后,过滤,将产物乙分离出来
C. ![]() 和
和![]() 可发生置换反应,将等物质的量的
可发生置换反应,将等物质的量的![]() 、
、![]() 混合,充分反应,被氧化的B元素与未被氧化的B元素质量之比是1∶1
混合,充分反应,被氧化的B元素与未被氧化的B元素质量之比是1∶1
D.若甲是Cu,乙是![]() ,设计电解池实现该置换反应,则铜片为阳极
,设计电解池实现该置换反应,则铜片为阳极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com