
【题目】含氮化合物在生产、生命活动中有重要的作用。回答下列问题:
(1)已知4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H1=-alkJ/mol,4NH3(g)+6NO(g)=5N2(g)+6H2O(g)△H2=-bkJ/mol,H2O(1)=H2O(g)△H3=+ckJ/mol,写出在298K时,氨气燃烧生成N2的热化学方程式___________。
(2)肌肉中的肌红蛋白(Mb)可与O2结合生成MbO2:Mb(aq)+O2(g)![]() MbO2(aq),其中k正和k逆分别表示正反应和逆反应的速率常数,即V正=k正·c(Mb)·P(O2),V逆=k逆·c(MbO2)。37℃时测得肌红蛋白的结合度(α)与P(O2)的关系如下表[结合度(α)指已与O2结合的肌红蛋白占总肌红蛋白的百分比]:
MbO2(aq),其中k正和k逆分别表示正反应和逆反应的速率常数,即V正=k正·c(Mb)·P(O2),V逆=k逆·c(MbO2)。37℃时测得肌红蛋白的结合度(α)与P(O2)的关系如下表[结合度(α)指已与O2结合的肌红蛋白占总肌红蛋白的百分比]:
P(O2) | 0.50 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 | 6.00 |
α(MbO2%) | 50.0 | 67.0 | 80.0 | 85.0 | 88.0 | 90.3 | 91.0 |
①计算37℃、P(O2)为2.00kPa时,上述反应的平衡常数K=___________。
②导出平衡时肌红蛋白与O2的结合度(α)与O2的压强[P(O2)]之间的关系式α=___________(用含有k正、k逆的式子表示)。
(3)构成肌红蛋白的甘氨酸(NH2CH2COOH)是一种两性物质,在溶液中以三种离子形式存在,其转化关系如下:
![]()
![]()
![]()
![]()
![]()
在甘氨酸溶液中加入酸或碱,三种离子的百分含量与![]() 的关系如图所示:
的关系如图所示:

①纯甘氨酸溶液呈___________性;当溶液呈中性时三种离子的浓度由大到小的顺序为___________。
②向![]() =8的溶液中加入过量HCl时,反应的离子方程式为___________。
=8的溶液中加入过量HCl时,反应的离子方程式为___________。
③用电位滴定法可测定某甘氨酸样品的纯度.

称取样品150mg,在一定条件下,用0.1000mol/L的高氯酸溶液滴定(与甘氨酸1︰1发生反应),测得电压变化与滴入HClO4溶液的体积关系如下图。做空白对照实验,消耗HClO4溶液的体积为0.25mL,该样品的纯度为___________%(计算结果保留一位小数)

【答案】4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H=![]() kJ/mol 2.00
kJ/mol 2.00 ![]() 酸 H3N+CH2COO->H2NCH2COO->H3N+CH2COOH H2NCH2COO-+2H+=H3N+CH2COOH 85.0
酸 H3N+CH2COO->H2NCH2COO->H3N+CH2COOH H2NCH2COO-+2H+=H3N+CH2COOH 85.0
【解析】
(1) 根据盖斯定律,将三个热化学方程式叠加,可得相应的热化学方程式;
(2)①根据平衡常数的含义,结合37℃、P(O2)为2.00kPa时a(MbO2)计算平衡常数;
②根据反应达到平衡时,V正=V逆,结合平衡常数定义式进行变性,可得表达式;
(3)①根据甘氨酸的存在形式与溶液酸碱性的关系,先判断I、II、III分别为H2NCH2COO-、H3N+CH2COO-和H3N+CH2COOH,若只含有H3N+CH2COO-,此时lg![]() ,结合溶液的Kw可判断溶液的pH、确定溶液的酸碱性;当溶液呈中性时,lg
,结合溶液的Kw可判断溶液的pH、确定溶液的酸碱性;当溶液呈中性时,lg![]() =0,根据图示判断微粒浓度大小;
=0,根据图示判断微粒浓度大小;
②根据lg![]() =8时,微粒存在有H2NCH2COO-、H3N+CH2COOH,盐酸过量,H2NCH2COO-反应变为H3N+CH2COOH,书写反应方程式;
=8时,微粒存在有H2NCH2COO-、H3N+CH2COOH,盐酸过量,H2NCH2COO-反应变为H3N+CH2COOH,书写反应方程式;
③结合滴定突跃时溶液体积读数与空白读数差,计算出消耗高氯酸的体积,利用n=cV计算出高氯酸的物质的量,根据恰好反应时甘氨酸与高氯酸的物质的量的比是1:1,计算出甘氨酸质量,利用甘氨酸质量与样品质量差计算得到甘氨酸的纯度。
(1) ①4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H1=-alkJ/mol,
②4NH3(g)+6NO(g)=5N2(g)+6H2O(g)△H2=-bkJ/mol,
③H2O(1)=H2O(g)△H3=+ckJ/mol,将①×3+②×2-③×30,整理可得热化学方程式:4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H=![]() kJ/mol;
kJ/mol;
(2)①37℃、P(O2)=2.00kPa时,结合度为80%,化学平均常数K=![]() kPa-1;
kPa-1;
②由结合度的定义式可知,反应达平衡时,V正=V逆,所以K=![]() ,可求出c(MbO2)=
,可求出c(MbO2)=![]() ,代入结合度定义式
,代入结合度定义式![]() =
=![]() 可得a=
可得a=![]() ;
;
①甘氨酸的三种存在形式:H3N+CH2COOH、H3N+CH2COO-和H2NCH2span>COO-应分别在强酸性至强碱性中存在,由此判断,图中I、II和III分别为H2NCH2COO-、H3N+CH2COO-和H3N+CH2COOH,当lg![]() =-8时,溶液显碱性,溶液中存在的主要是H2NCH2COO-,它与过量的HCl反应生成H3N+CH2COOH。由图可知纯甘氨酸溶液呈酸性(实际在5.9左右),溶液呈中性时,lg
=-8时,溶液显碱性,溶液中存在的主要是H2NCH2COO-,它与过量的HCl反应生成H3N+CH2COOH。由图可知纯甘氨酸溶液呈酸性(实际在5.9左右),溶液呈中性时,lg![]() =0,中性时H3N+CH2COO-> H2NCH2COO->H3N+CH2COOH;②根据lg
=0,中性时H3N+CH2COO-> H2NCH2COO->H3N+CH2COOH;②根据lg![]() =8时,微粒存在有H2NCH2COO-、H3N+CH2COOH,由于加入的盐酸过量,所以,发生反应H2NCH2COO-变为H3N+CH2COOH,反应方程式为H2NCH2COO-+2H+=H3N+CH2COOH;
=8时,微粒存在有H2NCH2COO-、H3N+CH2COOH,由于加入的盐酸过量,所以,发生反应H2NCH2COO-变为H3N+CH2COOH,反应方程式为H2NCH2COO-+2H+=H3N+CH2COOH;
根据滴定曲线的突跃范围,消耗HClO4溶液17.25mL,减去空白实验的0.25mL,实际消耗滴定液17.00mL。n(HClO4)= 0.1000mol/L×0.01700L=0.0017mol,则n(甘氨酸)=0.0017mol,甘氨酸的质量为m(甘氨酸)=0.0017mol×75g/mol=0.1275g,所以甘氨酸的纯度为:(0.1275g÷0.150g)×100%=85.0%。


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
【题目】氯碱厂用电解饱和食盐水制取烧碱,同时制盐酸的工艺流程如下:

(1)氯气加压能得到液氯,这利用了氯气______________的物理性质。
(2)在HCl合成塔中是_______气过量。
(3)按照图示流程,为了制得100吨36.5%的盐酸,理论上需氯化钠_______吨。
(4)实验室制备HCl气体的化学方程式:_________。
(5)利用HCl合成时放出的热量来产生水蒸汽,用于NaOH溶液的蒸发,这样做的优点是_______。
(6)氯化氢气体可做美丽的喷泉实验。标准状况下,用容积为V升的圆底烧瓶,采用排空气法收集干燥的氯化氢,所得气体的平均式量是34.625。喷泉实验后,烧瓶中的溶液的体积为____,物质的量浓度为___。
(7)某化学兴趣小组进行粗盐(含有少量氯化钙和硫酸镁杂质)提纯实验,请结合实验过程回答下列问题。
步骤一:称取10g粗盐,倒入烧杯中后加入30mL水溶解。为加快溶解速率,可采取的方法是______(任写1种)。步骤二:依次加入稍过量的沉淀剂,充分反应后得到大量沉淀。沉淀剂加入顺序依次为(用化学式表示):__________。步骤三:将混合物进行过滤,取滤液进行下一步操作。步骤四:往滤液中加入适量的____(填试剂名称),调节pH到7(用pH试纸测定),若该试剂不小心加过量,对所得到氯化钠的纯度____(填“有”或“没有”)影响。步骤五:将滤液倒入______中进行加热,等到______时,停止加热,利用余热蒸干。步骤六:晶体转入试剂瓶中待用。在步骤三和五中,玻璃棒的作用依次是____、____。若最终得到的氯化钠固体中还含有微量的NaBr和KCl,更简单的除杂方法是______。已知氯元素的近似相对原子质量为35.5,由![]() 、
、![]() 、
、![]() 构成的11.7gNaCl中含有
构成的11.7gNaCl中含有![]() ___克。
___克。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辉钼矿的主要成分是MoS2(Mo呈+4价),含少量SiO2以及Re的化合物等杂质。由辉钼矿可制得金属缓蚀剂钼酸钠晶体(Na2MoO4·10H2O)、催化剂Mo2C和氧化剂KReO4,其主要流程如下:

(1)焙烧辉钼矿时发生的反应及反应开始的温度(T)与真空度的关系如下图所示:(真空度P/P0表示反应时的压强与标准大气压之比)

为获得碳化钼,在真空度为0.5的条件下,适宜的反应温度应控制___________。
(2)焙烧时,生成Mo2C的反应中被还原的元素有___________(填元素符号);水洗烧结物时,洗去的物质除Na2S、Na2CO3之外,还有___________。
(3)用 NaClO2氧化MoS2时,MoS2转化为MoO42-和SO42-,写出该反应的离子方程式___________。
(4)已知钼酸钠的溶解度曲线如下图,获得Na2MoO4·10H2O的操作A为___________、___________、过滤。
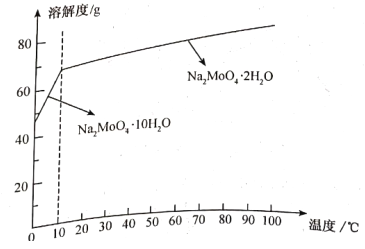
(5)生成KReO4晶体的化学方程式为___________;加入KCl时,同时加入乙醇的作用是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理(平衡移动原理)解释的是
①铁在潮湿的空气中容易生锈
②二氧化氮与四氧化氮的平衡体系,加压缩小体积后颜色加深
③实验室可用排饱和食盐水的方法收集氯气
④钠与氯化钾共融制备钾 Na(l)+KCl(l)![]() K(g)+NaCl(l)
K(g)+NaCl(l)
⑤开启啤酒瓶后,瓶中马上泛起大量泡沫
A. ③④ B. ①② C. ①⑤ D. ①②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(4分)水的电离平衡曲线如图所示:
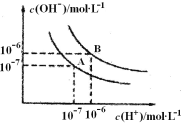
(1)A点表示25℃时水电离平衡时离子的浓度,当温度升高到100℃时,水的电离平衡状态变到B点,则100℃时水的离子积为_____________。
(2) 100℃时,若10体积的某强酸溶液与l体积的某强碱溶液混合后溶液呈中性,则混合之前,该强酸的pHa与强碱的pHb之间应满足的关系是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,一定体积的密闭容器中有如下平衡:H2(g)+I2(g)![]() 2HI(g)。已知H2和I2的起始浓度均为0.10 mol·L-1时,达平衡时HI的浓度为0.16 mol·L-1。若H2和I2的起始浓度均变为0.20 mol·L-1,则平衡时H2的浓度(mol·L-1)是
2HI(g)。已知H2和I2的起始浓度均为0.10 mol·L-1时,达平衡时HI的浓度为0.16 mol·L-1。若H2和I2的起始浓度均变为0.20 mol·L-1,则平衡时H2的浓度(mol·L-1)是
A. 0.16 B. 0.08 C. 0.04 D. 0.02
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下列两种方法制取氯气:①用含HCl 146g的浓盐酸与足量的MnO2反应;②用87g MnO2与足量的浓盐酸反应,则所得Cl2质量
A. ①比②多B. ②比①多C. 一样多D. 无法比较
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向aL密闭容器中加入1molX气体和2molY气体,发生如下反应:X(g)+2Y(g)![]() 2Z(g),此反应达到平衡的标志是
2Z(g),此反应达到平衡的标志是
A. 容器内压强不随时间变化
B. 容器内气体密度不随时间变化
C. 容器内X、Y、Z的浓度之比为1:2:2
D. 单位时间消耗0.1molX同时生成0.2molZ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com