
【题目】(4分)水的电离平衡曲线如图所示:
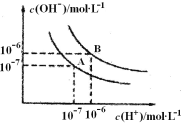
(1)A点表示25℃时水电离平衡时离子的浓度,当温度升高到100℃时,水的电离平衡状态变到B点,则100℃时水的离子积为_____________。
(2) 100℃时,若10体积的某强酸溶液与l体积的某强碱溶液混合后溶液呈中性,则混合之前,该强酸的pHa与强碱的pHb之间应满足的关系是______________。
科目:高中化学 来源: 题型:
【题目】某化学学习小组用如下图所示装置制备、收集Cl2,并进行性质验证实验(夹持装置略去)。下列说法正确的是( )

A. 用![]() 和浓盐酸制备
和浓盐酸制备![]() 时,只选
时,只选![]()
B. ![]() 用于
用于![]() 收集时,a为进气口
收集时,a为进气口
C. ![]() 中加入NaBr溶液和
中加入NaBr溶液和![]() ,通入
,通入![]() 反应后振荡、静置,下层溶液呈橙红色
反应后振荡、静置,下层溶液呈橙红色
D. ![]() 中通入
中通入![]() 使品红溶液褪色后,取出溶液加热可恢复红色
使品红溶液褪色后,取出溶液加热可恢复红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究铜跟浓硫酸的反应,用如图装置进行有关实验。请回答:
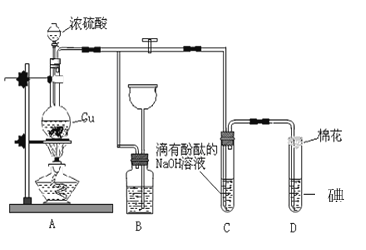
(1)装置A中发生的化学反应的化学方程式: _________________________________。
(2)装置B 的作用是__________________,B中广口瓶内应盛放的液体是_________(填序号)
①水 ②澄清石灰水
③Na2CO3溶液 ④饱和的NaHSO3 溶液
(3)装置C和D 中产生的现象相同,但原因却不同。C中反应的方程式:_______________________________________,而D 中则是由于SO2 具有_______性,D中反应的方程式:________________________。
(4)实验中,0.1molCu与含0.2mol硫酸的溶液反应后,铜和硫酸都有剩余。 可以证明有余酸的实验方案是___________
A.可再加入锌粒 B.可再加入氯化钡溶液
C.再加入银粉 D.再滴入碳酸氢钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤是重要的化工原料,用煤作燃料不仅浪费,而且因烟煤中含有硫的化合物(FeS2)燃烧时生成SO2气体造成环境污染。假设一个具有3万户人口的小型城市,平均每户燃煤5kg,这种煤含FeS25%,在燃烧时如有90%的S转化为SO2,并被排入大气中,试计算:
(1)该城市仅居民作燃料用煤一年(365天)向大气中排放SO2的总质量达多少吨?______
(2)假如这些SO2全部能回收,可生产98%的H2SO4多少吨?____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氮化合物在生产、生命活动中有重要的作用。回答下列问题:
(1)已知4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H1=-alkJ/mol,4NH3(g)+6NO(g)=5N2(g)+6H2O(g)△H2=-bkJ/mol,H2O(1)=H2O(g)△H3=+ckJ/mol,写出在298K时,氨气燃烧生成N2的热化学方程式___________。
(2)肌肉中的肌红蛋白(Mb)可与O2结合生成MbO2:Mb(aq)+O2(g)![]() MbO2(aq),其中k正和k逆分别表示正反应和逆反应的速率常数,即V正=k正·c(Mb)·P(O2),V逆=k逆·c(MbO2)。37℃时测得肌红蛋白的结合度(α)与P(O2)的关系如下表[结合度(α)指已与O2结合的肌红蛋白占总肌红蛋白的百分比]:
MbO2(aq),其中k正和k逆分别表示正反应和逆反应的速率常数,即V正=k正·c(Mb)·P(O2),V逆=k逆·c(MbO2)。37℃时测得肌红蛋白的结合度(α)与P(O2)的关系如下表[结合度(α)指已与O2结合的肌红蛋白占总肌红蛋白的百分比]:
P(O2) | 0.50 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 | 6.00 |
α(MbO2%) | 50.0 | 67.0 | 80.0 | 85.0 | 88.0 | 90.3 | 91.0 |
①计算37℃、P(O2)为2.00kPa时,上述反应的平衡常数K=___________。
②导出平衡时肌红蛋白与O2的结合度(α)与O2的压强[P(O2)]之间的关系式α=___________(用含有k正、k逆的式子表示)。
(3)构成肌红蛋白的甘氨酸(NH2CH2COOH)是一种两性物质,在溶液中以三种离子形式存在,其转化关系如下:
![]()
![]()
![]()
![]()
![]()
在甘氨酸溶液中加入酸或碱,三种离子的百分含量与![]() 的关系如图所示:
的关系如图所示:

①纯甘氨酸溶液呈___________性;当溶液呈中性时三种离子的浓度由大到小的顺序为___________。
②向![]() =8的溶液中加入过量HCl时,反应的离子方程式为___________。
=8的溶液中加入过量HCl时,反应的离子方程式为___________。
③用电位滴定法可测定某甘氨酸样品的纯度.

称取样品150mg,在一定条件下,用0.1000mol/L的高氯酸溶液滴定(与甘氨酸1︰1发生反应),测得电压变化与滴入HClO4溶液的体积关系如下图。做空白对照实验,消耗HClO4溶液的体积为0.25mL,该样品的纯度为___________%(计算结果保留一位小数)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图为某化学反应速率一时间图。在t1时刻升高温度或增大压强,都符合图所示变化的反应是

A. 4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)ΔH<0
4NO(g)+6H2O(g)ΔH<0
B. 2SO2(g)+O2(g)![]() 2SO3(g)ΔH< 0
2SO3(g)ΔH< 0
C. H2(g)+I2(g)![]() 2HI(g)ΔH>0
2HI(g)ΔH>0
D. C(s)+H2O(g)![]() CO(g)+H2(g)ΔH>0
CO(g)+H2(g)ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知地球上元素原子各电子层最多能容纳的电子数为2n2(n表示电子层序数),若X星球上的元素原子各电子层最多能容纳的电子数为n(n+1),n表示电子层数,该星球上元素原子的电子排布的其他规则与地球相同,回答下列问题:
(1)X星球上的质子数为5的元素原子最外层电子数为___个;
(2)X星球上的质子数为9的元素原子的结构示意图为___,该元素属于___元素(填“金属”或“非金属”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W为五种短周期元素,X、Y、Z是原子序数依次增大的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76 g·L-1;W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是
A. 原子半径:W>Z>Y>X>M
B. 常见气态氢化物的稳定性:X<Y<Z
C. 1 mol WM溶于足量水中完全反应,共转移2 mol电子
D. 由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com