
【题目】已知地球上元素原子各电子层最多能容纳的电子数为2n2(n表示电子层序数),若X星球上的元素原子各电子层最多能容纳的电子数为n(n+1),n表示电子层数,该星球上元素原子的电子排布的其他规则与地球相同,回答下列问题:
(1)X星球上的质子数为5的元素原子最外层电子数为___个;
(2)X星球上的质子数为9的元素原子的结构示意图为___,该元素属于___元素(填“金属”或“非金属”)。
科目:高中化学 来源: 题型:
【题目】一定温度下,固定体积的密闭容器中发生反应M(g)+N(g)![]() 2W(g),能说明该反应一定达到平衡的是( )
2W(g),能说明该反应一定达到平衡的是( )
A.v(W)消耗=v(W)生成B.v正=v逆=0
C.容器内气体总质量不变D.n(M)∶n(N)∶n(W)=1∶1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(4分)水的电离平衡曲线如图所示:
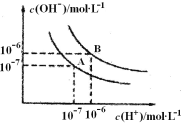
(1)A点表示25℃时水电离平衡时离子的浓度,当温度升高到100℃时,水的电离平衡状态变到B点,则100℃时水的离子积为_____________。
(2) 100℃时,若10体积的某强酸溶液与l体积的某强碱溶液混合后溶液呈中性,则混合之前,该强酸的pHa与强碱的pHb之间应满足的关系是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铁粉与水蒸气在不同温度下反应,所得黑色固体产物的成分不同,某化学小组的同学为测定该固体产物的组成,称取168mg纯铁粉,按下列步骤进行实验:
①如图所示连接好装置检查气密性装入药品
②打开K,加热某装置,一段时间后,再加热另一装置;
③反应完成后,关闭K,停止加热,冷却后读取收集到的气体的体积

回答下列问题:
(1)实验中先点燃___________处的酒精灯,该操作在将D中的导管伸入量筒中准备收集气体之______ (填“前”或“后”)
(2)下列实验操作的目的是:
①将铁粉和石棉绒混合均匀___________;
②关闭K___________。
(3)判断铁粉与水蒸气反应已经完成的现象是___________。
(4)有同学认为用D装置测量气体的体积时,伸入量筒中的导管应适当加长,该同学的理由是___________。
(5)用改进后的正确装置进行实验,收集到气体的体积为67.2mL(已换算成标准状况),则固体产物的组成为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下列两种方法制取氯气:①用含HCl 146g的浓盐酸与足量的MnO2反应;②用87g MnO2与足量的浓盐酸反应,则所得Cl2质量
A. ①比②多B. ②比①多C. 一样多D. 无法比较
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用CO生产燃料甲醇。一定温度和容积条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。图1表示反应中的能量变化;图2表示一定温度下,在体积为1L的密闭容器中加入2mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
CH3OH(g)。图1表示反应中的能量变化;图2表示一定温度下,在体积为1L的密闭容器中加入2mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。

请回答下列问题:
(1)在“图1”中,曲线____填“a”或“b”)表示使用了催化剂;没有使用催化剂时,在该温度和压强条件下反应CO(g)+2H2(g)![]() CH3OH(g)的△H= _________________________ 。
CH3OH(g)的△H= _________________________ 。
(2)下列说法正确的是 (_________)
A.起始充入的CO的物质的量为1mol
B.增加CO的浓度,H2的转化率会增大
C.容器中压强恒定时,反应达到平衡状态
(3)从反应开始到建立平衡,υ(CO)= _______;达到平衡时,c(H2)= ____ ,该温度下CO(g)+2H2(g) ![]() CH3OH(g)的化学平衡常数为______________。达到平衡后若保持其它条件不变,将容器体积压缩为0.5L,则平衡___________移动 (填“正向”、“逆向”或“不”)。
CH3OH(g)的化学平衡常数为______________。达到平衡后若保持其它条件不变,将容器体积压缩为0.5L,则平衡___________移动 (填“正向”、“逆向”或“不”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱工厂生产的氯气和氢气可以进一步用于生产盐酸,主要过程如下:

(1)其中关键的一步为氯气和氢气在燃烧管口燃烧生成HCl,氯气有毒,应采取的措施是____。合成盐酸厂要求合成气中的HCl的含量要大于97%,试用最简便的方法进行分析是否含量大于97%____。
(2)氯碱工厂生产的氯气和氢氧化钠溶液可以用于制取“84消毒液”,反应的化学方程式为__。
(3)某同学欲证明盐酸与氯化氢气体性质不同,他分别向A、B、C三支洁净试管中各放入一片干燥的蓝色石蕊试纸,然后往A试管内加入盐酸,试纸显___色,往B试管中通入干燥的氯化氢气体,试纸显___色.最后向C试管中加入物质___(填化学式),他之所以加入这种物质的理由是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电镀废液中Cr2O7可通过下列反应转化成铬黄(PbCrO4):
Cr2O![]() (aq)+2Pb2+(aq)+H2O(l)
(aq)+2Pb2+(aq)+H2O(l) ![]() 2PbCrO4(s)+2H+(aq) ΔH<0
2PbCrO4(s)+2H+(aq) ΔH<0
该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是 ( )。
A. 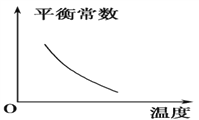 B.
B. 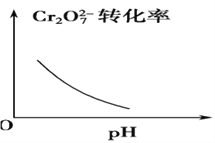
C.  D.
D. 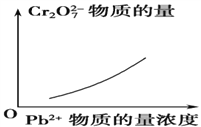
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验有助于理解化学知识,形成化学观念,提高探究与创新能力,提升科学素养。实验室用食盐晶体与浓硫酸在微热条件下反应制取氯化氢气体。

(1)该反应的化学方程式为_________________________________________________,氯化氢气体的发生装置应该选择装置___________(填装置的编号,下同)。由于氯化氢气体有害,所以实验室用装置D来收集氯化氢,收集氯化氢时,气体从________管(填“a”或“b”)进入。用水吸收多余的氯化氢气体时,应该选择装置__________,这是为了_________________________________________________。
(2)要得到干燥的氯化氢气体,还需要在制取和收集装置之间插入一个装置D,此时D中装入的液体应该是______________________。
(3)气体发生在装置的选择要考虑反应物状态和反应条件等因素。
实验室制取氧气(氯酸钾和二氧化锰)和二氧化碳的发生装置都不用装置B,其原因分别是制取氧气时____________________________,制二氧化碳时___________________________。
(4)将标准状况下的200体积HCl气体溶于1体积水中,得到密度为1.12g/mL的盐酸,则该盐酸的物质的量浓度是_______________。 (保留两位小数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com