
【题目】化学实验有助于理解化学知识,形成化学观念,提高探究与创新能力,提升科学素养。实验室用食盐晶体与浓硫酸在微热条件下反应制取氯化氢气体。

(1)该反应的化学方程式为_________________________________________________,氯化氢气体的发生装置应该选择装置___________(填装置的编号,下同)。由于氯化氢气体有害,所以实验室用装置D来收集氯化氢,收集氯化氢时,气体从________管(填“a”或“b”)进入。用水吸收多余的氯化氢气体时,应该选择装置__________,这是为了_________________________________________________。
(2)要得到干燥的氯化氢气体,还需要在制取和收集装置之间插入一个装置D,此时D中装入的液体应该是______________________。
(3)气体发生在装置的选择要考虑反应物状态和反应条件等因素。
实验室制取氧气(氯酸钾和二氧化锰)和二氧化碳的发生装置都不用装置B,其原因分别是制取氧气时____________________________,制二氧化碳时___________________________。
(4)将标准状况下的200体积HCl气体溶于1体积水中,得到密度为1.12g/mL的盐酸,则该盐酸的物质的量浓度是_______________。 (保留两位小数)
【答案】NaCl+H2SO4(浓)![]() NaHSO4+HCl↑ B a F 防止倒吸 浓硫酸 制取氧气时反应物是固体和固体 制取二氧化碳时反应不需要加热 7.54moL/L
NaHSO4+HCl↑ B a F 防止倒吸 浓硫酸 制取氧气时反应物是固体和固体 制取二氧化碳时反应不需要加热 7.54moL/L
【解析】
(1)用食盐晶体与浓硫酸在微热条件下反应生成氯化氢气体和硫酸氢钠;实验室利用二氧化锰和浓盐酸加热反应生成氯化锰,氯气和水,是固体+固体=气体,选择装置B;氯化氢是比空气重的极易溶于水的气体需要用向上排气法收集,导气管长进短处,多余的氯化氢气体用水吸收要防止倒吸;
(2)装置D干燥气体是利用洗气选择液体干燥剂,用于干燥氯化氢气体的干燥剂选择浓硫酸;
(3)制取氧气时反应物是固体和固体 ,制二氧化碳时反应不需要加热
(4)200体积HCl气体溶于1体积水中,体积之比等于物质的量之比,看成200L和1L,n=200/22.4,V=![]() *10-3L,C=
*10-3L,C=![]()
(1)实验室用食盐晶体与浓硫酸在微热条件下反应制取氯化氢气体,反应生成氯化氢气体和硫酸氢钠,反应的化学方程式为
NaCl(s)+H2SO4(浓)=== NaHSO4+HCl↑,实验室利用二氧化锰和浓盐酸加热反应生成氯化锰,氯气和水,是固体+固体加热制气体,选择装置B;氯化氢是比空气重的极易溶于水的气体需要用向上排气法收集,导气管长进短处,应从a处进,多余的氯化氢气体用水吸收要防止倒吸,应选择装置F防止水倒吸入集气瓶,
故答案为:NaCl(s)+H2SO4(浓)=NaHSO4+HCl↑;B;a;F;水倒吸入集气瓶;
(2)装置D干燥气体是利用洗气,应选择液体干燥剂,能用于干燥氯化氢气体的干燥剂选择浓硫酸,
故答案为:浓硫酸;
(3)实验室制取氧气(氯酸钾和二氧化锰)和二氧化碳的发生装置都不用装置B,其原因分别是制取氧气时反应物是固体和固体 ,制二氧化碳时反应不需要加热
故答案为:制取氧气时反应物是固体和固体;制取二氧化碳时反应不需要加热
(4)将标准状况下的200体积HCl气体溶于1体积水中,体积之比等于物质的量之比,看成200L和1L,得到密度为1.12g/mL的盐酸,所以n=200/22.4
V=![]() *10-3L
*10-3L![]() C=
C=![]() =7.54moL/L
=7.54moL/L
故答案为:7.54moL/L


科目:高中化学 来源: 题型:
【题目】已知地球上元素原子各电子层最多能容纳的电子数为2n2(n表示电子层序数),若X星球上的元素原子各电子层最多能容纳的电子数为n(n+1),n表示电子层数,该星球上元素原子的电子排布的其他规则与地球相同,回答下列问题:
(1)X星球上的质子数为5的元素原子最外层电子数为___个;
(2)X星球上的质子数为9的元素原子的结构示意图为___,该元素属于___元素(填“金属”或“非金属”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W为五种短周期元素,X、Y、Z是原子序数依次增大的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76 g·L-1;W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是
A. 原子半径:W>Z>Y>X>M
B. 常见气态氢化物的稳定性:X<Y<Z
C. 1 mol WM溶于足量水中完全反应,共转移2 mol电子
D. 由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S燃料电池应用前景非常广阔,该电池示意图如下。下列说法正确的是( )
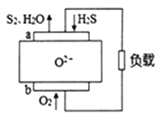
A. 电极a是正极 B. O2-由电极a移向电极b
C. 电极 a 的反应式为:2H2S+2O2--4e-=S2+2H2O D. 当通入1.12LO2,转移电子数0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将少量饱和FeCl3溶液分别滴加到下列物质中,得到三种分散系甲、乙、丙。

(1)将丙继续加热煮沸至液体呈红褐色,反应的化学方程式为____________________________。
(2)如何用最简单的方法判断丙中是否成功制备出胶体?__________。
(3)向经过检验后的丙中逐滴加人盐酸,会出现一系列变化:
①先出现和乙中相同的现象,原因是__________;
②随后发生变化得到和甲相同的溶液,此反应的离子方程式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A.标准状况下,1mol任何物质的体积约为22.4L
B.O2的摩尔质量是32g/mol,所以2molO2的质量是64g
C.氯化氢气体的摩尔质量与NA 个氯化氢分子的质量在数值上相等
D.1mol氢气和氧气的混合气体中含有的分子数为6.02×1023 个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氯水的叙述,不正确的是( )
A. 新制的氯水中,溶质既有分子又有离子
B. 新制的氯水是无色透明的液体,有酸性和漂白性
C. 光照氯水有气泡逸出,该气体是O2
D. 氯水放置数天后酸性将增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼(Mo)是一种重要的过渡金属元素,工业上由钼精矿(主要成分是MoS2)制备单质钼和钼酸钠晶体(Na2MoO42H2O)的流程如下:

(1) Na2MoO42H2O中Mo元素的化合价为____;钼精矿焙烧的主要反应中,氧化剂和还原剂物质的量之比为________。
(2)流程中由Na2MoO4溶液获得晶体的操作是_________、过滤、洗涤、干燥。加入Na2CO3溶浸时发生的主要反应的离子方程式为______________。
(3)操作1中,所得Na2MoO4溶液中含SO42+杂质,其中c(MoO42+)0.80mol/L,c(SO42-)=0.04mol/L在结晶前需加入Ba(OH)2固体以除去溶液中的SO42-。当 BaMoO4开始沉淀时,SO42-的去除率是______。[Ksp(BaSO4)=1.1×10-10、Ksp( BaMoO4)=4.0×10-8,溶液体积变化可忽略]
(4)工业上钼精矿在酸性条件下,加入NaNO3溶液,也可以制备钼酸钠,该法的优点是_____。
(5)高纯Mo可用于制造电池级MoS2,Li-MoS2电池是一种性能优异的二次电池,其电池反应为:xLi+nMoS2![]() Lix(MoS2)n,该电池放电时正极反应为______________;充电时Li+移动方向为________(填“由阳极移向阴极”或“由阴极移向阳极”)。
Lix(MoS2)n,该电池放电时正极反应为______________;充电时Li+移动方向为________(填“由阳极移向阴极”或“由阴极移向阳极”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.18 g冰水混合物中有NA个原子和10NA个电子
B.常温常压下16 g 氧气和臭氧混合气体含有NA个氧原子
C.标准状况下,33.6 L水含有1.5NA个水分子
D.2.24 L二氧化碳中含有0.3NA个原子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com