
【题目】一定温度下,固定体积的密闭容器中发生反应M(g)+N(g)![]() 2W(g),能说明该反应一定达到平衡的是( )
2W(g),能说明该反应一定达到平衡的是( )
A.v(W)消耗=v(W)生成B.v正=v逆=0
C.容器内气体总质量不变D.n(M)∶n(N)∶n(W)=1∶1∶2
【答案】A
【解析】
当化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再发生变化,由此衍生的一些物理量不变。
A. v(W)消耗=v(W)生成,正逆反应速率相等,各物质的浓度不再发生变化,能说明该反应一定达到平衡,故A正确;
B. v正=v逆,正逆反应速率相等,但反应没有停止,速率不为0,不能说明该反应一定达到平衡,故B错误;
C. 该反应是一个反应前后全是气体的反应,无论该反应是否达到平衡状态,容器内气体总质量始终不变,所以不能根据平衡体系的容器内气体总质量不变判断是否达到平衡状态,故C错误;
D. n(M)∶n(N)∶n(W)=1∶1∶2,不能确定正逆反应速率相等,不能说明该反应一定达到平衡,故D错误;
故选A。


科目:高中化学 来源: 题型:
【题目】根据要求完成下列实验。(a、b为弹餐夹,其他装置略去)
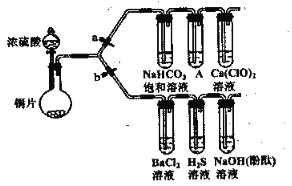
I验证SO2具有氧化性、还原性和酸性氧化物的通性。
(1) 连接仪器、检查装置气密性、加药品后,打开b (关闭a),然后滴入浓硫酸,加热。装有浓硫酸的仪器名称是___________,铜与浓硫酸反应的化学方程式是___________ 。
(2) 能验证SO2具有氧化性的实验现象是__________________________________________。
(3) 装有BaCl2溶液的试管中无任何现象,将其分成两份,分别滴加氨水和氯水,均产生白色沉淀,沉淀的化学式分别是___________,___________。写出其中SO2显示还原性并生成白色沉淀的总的离子方程式____________________________________________。
(4) 能验证SO2具有酸性氧化物的通性的实验现象是________________________________, 若通入过量的SO2,其化学方程式是____________________________________________。
II验证酸性的相对强弱:碳酸>次氯酸。(已知酸性:亚硫酸>碳酸)
(5) 打开a关闭b。装置A中的足量的试剂是___________。利用该装置能否判断碳酸的酸性比次氯酸强,理由是_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学学习小组用如下图所示装置制备、收集Cl2,并进行性质验证实验(夹持装置略去)。下列说法正确的是( )

A. 用![]() 和浓盐酸制备
和浓盐酸制备![]() 时,只选
时,只选![]()
B. ![]() 用于
用于![]() 收集时,a为进气口
收集时,a为进气口
C. ![]() 中加入NaBr溶液和
中加入NaBr溶液和![]() ,通入
,通入![]() 反应后振荡、静置,下层溶液呈橙红色
反应后振荡、静置,下层溶液呈橙红色
D. ![]() 中通入
中通入![]() 使品红溶液褪色后,取出溶液加热可恢复红色
使品红溶液褪色后,取出溶液加热可恢复红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,不属于四种基本反应类型但属于氧化还原反应的是
A.2FeCl3+Cu=2FeCl2+CuCl2
B.CuSO4+H2S=CuS↓+H2SO4
C.Cu2(OH)2CO3![]() 2CuO+CO2↑+H2O
2CuO+CO2↑+H2O
D.4Fe(OH)2+O2+2H2O=4Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是
2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是

A. ①压强对反应的影响(p2>p1) B. ②温度对反应的影响
C. ③平衡体系增加N2对反应的影响 D. ④催化剂对反应的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是温度和压强对X + Y ![]() 2Z 反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )
2Z 反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )

A. 上述可逆反应的正反应为吸热反应
B. X、Y、Z均为气态
C. X和Y是气态,Z为固态
D. 上述反应的逆反应的△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究铜跟浓硫酸的反应,用如图装置进行有关实验。请回答:
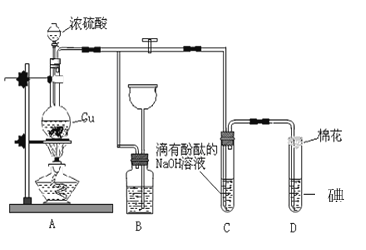
(1)装置A中发生的化学反应的化学方程式: _________________________________。
(2)装置B 的作用是__________________,B中广口瓶内应盛放的液体是_________(填序号)
①水 ②澄清石灰水
③Na2CO3溶液 ④饱和的NaHSO3 溶液
(3)装置C和D 中产生的现象相同,但原因却不同。C中反应的方程式:_______________________________________,而D 中则是由于SO2 具有_______性,D中反应的方程式:________________________。
(4)实验中,0.1molCu与含0.2mol硫酸的溶液反应后,铜和硫酸都有剩余。 可以证明有余酸的实验方案是___________
A.可再加入锌粒 B.可再加入氯化钡溶液
C.再加入银粉 D.再滴入碳酸氢钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤是重要的化工原料,用煤作燃料不仅浪费,而且因烟煤中含有硫的化合物(FeS2)燃烧时生成SO2气体造成环境污染。假设一个具有3万户人口的小型城市,平均每户燃煤5kg,这种煤含FeS25%,在燃烧时如有90%的S转化为SO2,并被排入大气中,试计算:
(1)该城市仅居民作燃料用煤一年(365天)向大气中排放SO2的总质量达多少吨?______
(2)假如这些SO2全部能回收,可生产98%的H2SO4多少吨?____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知地球上元素原子各电子层最多能容纳的电子数为2n2(n表示电子层序数),若X星球上的元素原子各电子层最多能容纳的电子数为n(n+1),n表示电子层数,该星球上元素原子的电子排布的其他规则与地球相同,回答下列问题:
(1)X星球上的质子数为5的元素原子最外层电子数为___个;
(2)X星球上的质子数为9的元素原子的结构示意图为___,该元素属于___元素(填“金属”或“非金属”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com