
【题目】将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中,进行铁的电化学腐蚀实验。下列有关该实验的说法正确的是( )

A.在此实验过程中铁元素被还原
B.铁腐蚀过程中化学能全部转化为电能
C.活性炭的存在会加速铁的腐蚀
D.以水代替NaCl溶液,铁不能发生吸氧腐蚀
【答案】C
【解析】
A、该装置中发生吸氧腐蚀,Fe作负极,Fe失电子生成亚铁离子;
B、铁腐蚀过程中部分化学能转化为热能、部分化学能转化为电能;
C、Fe、C和电解质溶液构成原电池,加速Fe的腐蚀;
D、弱酸性或中性条件下铁腐蚀吸氧腐蚀。
A、该装置中发生吸氧腐蚀,Fe作负极,Fe失电子生成亚铁离子,电极反应式为Fe-2e-=Fe2+,被氧化,故A错误;
B、铁腐蚀过程发生电化学反应,部分化学能转化为电能,且该过程放热,所以还存在化学能转化为热能的变化,故B错误;
C、Fe、C和电解质溶液构成原电池,Fe易失电子被腐蚀,加速Fe的腐蚀,故C正确;
D、铁在弱酸性或中性条件以及碱性条件下发生吸氧腐蚀,水代替NaCl溶液,溶液仍然呈中性,Fe发生吸氧腐蚀,故D错误;
故选:C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】以空气中的氮气为原料制备硝酸,合成线路如图(反应条件及部分反应物、生成物已略去):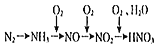 已知空气中含氮气的体积分数为78%,若用100 L(已折算成标准状况下)空气制备硝酸,则理论上可制得硝酸的量的计算式正确的是
已知空气中含氮气的体积分数为78%,若用100 L(已折算成标准状况下)空气制备硝酸,则理论上可制得硝酸的量的计算式正确的是
A.![]() B.
B.![]() mol
mol
C.![]() ×63 gD.2×100×78% L
×63 gD.2×100×78% L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸铝是一种不溶于水和醇,溶于强酸的白色粉末,是重要的媒染剂。某化学兴趣小组设计实验从废弃铝—空气海水电池中回收铝并制备草酸铝晶体。
【实验过程】
(一)铝的回收
①称取16.0g废弃电池原料;
②用98.3%的硫酸进行酸浸、稀释、除杂、过滤;
③将滤液蒸干得到硫酸铝固体mlg.
(二)草酸铝的制备
④配制250mL0.20mol/L的硫酸铝溶液;
⑤量取0.10mol/L的草酸铵溶液20.00mL,并加入一定量的分散剂,缓缓加入配制的硫酸铝溶液25.00mL,搅拌lh;
⑥沉化、抽滤、洗涤、干燥、称量固体质量为m2g。
【问题讨论】
(1)在用98.3%的硫酸进行酸浸时,浸出率与条件的关系如图所示:

由图可知浓硫酸为浸取剂的最佳条件为________。
(2)步骤③蒸干溶液所需的仪器有带铁圈的铁架台、酒精灯、_______、_______。
(3)铝的回收率为_______ (回收率=回收铝的质量/原料的质量)。
(4)步骤⑥中洗涤晶体时先用蒸馏水再用乙醇洗涤,这样洗涤的原因是_______。
(5)该研究小组在实验过程中发现,若用0.90mol/L草酸铵进行实验,会导致沉淀的质量远超过实际草酸铝的质量。经分析,结晶生成物为(NH4)xAly(C2O4)z·nH2O。 现称取3.990g该结晶水合物进行热分解,得到剩余固体的质量随温度变化的曲线如下图所示。己知450℃时剩余固体只有Al2O3。第II阶段共产生气体2.016L (标准状况),该气体通入足量的石灰水中产生3.000g沉淀。请计算求出该结晶水合物的化学式为______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如图所示:
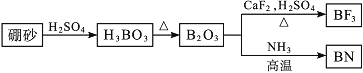
请回答下列问题:
(1)B和N相比,电负性较大的是___,BN中B元素的化合价为___;
(2)在BF3分子中,F—B—F的键角是___;BF3和过量NaF作用可生成NaBF4,BF4-的立体构型为___;
(3)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为___,层间作用力为___,六方相氮化硼晶体层内一个硼原子与相邻氮原子构成的空间构型为___,其结构与石墨相似却不导电,原因是___。
(4)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm。立方氮化硼晶胞中含有___个氮原子、___个硼原子,立方氮化硼的密度是___g·cm-3(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设 NA 为阿伏加德常数的数值,下列说法正确的是( )
A.18 g H2O 含有 10NA 个质子
B.1 mol 苯含有 3NA 个碳碳双键
C.标准状况下,22.4 L 氨水含有 NA 个 NH3 分子
D.常温下,112 g 铁片投入足量浓 H2SO4 中生成 3NA 个 SO2 分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组制备高铁酸钾(K2FeO4)并探究其性质。查阅文献,得到以下资料: K2FeO4为紫色固体,微溶于 KOH 溶液;具有强氧化性,在酸性或中性溶液中快速产生 O2,在碱性溶液中较稳定。
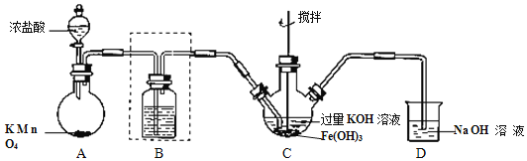
Ⅰ.制备 K2FeO4(夹持装置略)。
(1)A 为氯气的实验室发生装置。A 中反应方程式是______(锰被还原为 Mn2+)。若反应中有 0.5molCl2产生,则电子转移的数目为______。工业制氯气的反应方程式为______。
(2)装置 B 中盛放的试剂是______,简述该装置在制备高铁酸钾中的作用______。
(3)C 中得到紫色固体和溶液。C 中 Cl2发生的反应有:3Cl2+2Fe(OH)3+10KOH→2K2FeO4+6KCl+8H2O,根据该反应方程式得出:碱性条件下,氧化性 Cl2______FeO42-(填“>”或“<”)。另外C中还可能发生其他反应,请用离子方程式表示______。
Ⅱ.探究 K2FeO4 的性质
(4)甲同学取少量 K2FeO4 加入浑浊的泥浆水中,发现产生气体,搅拌,浑浊的泥浆水很快澄清。请简述 K2FeO4的净水原理。______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是工业电解饱和食盐水的装置示意图,下列有关说法中不正确的是( )

A.装置中出口①处的物质是氯气,出口②处的物质是氢气
B.该离子交换膜只能让阳离子通过,不能让阴离子通过
C.装置中发生反应的离子方程式为Cl-+2H+![]() Cl2↑+H2↑
Cl2↑+H2↑
D.该装置是将电能转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大运会时深圳新能源汽车上有一种质子交换膜燃料电池,工作原理如图所示,下列叙述正确的是( )
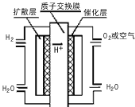
A.通入氧气的电极发生氧化反应
B.通入氢气的电极为正极
C.总反应式为O2+2H2![]() 2H2O
2H2O
D.正极的电极反应式为O2+4H++4e-=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 0.2 mol·L-1与0.1 mol·L-1 HClO溶液中c(H+)之比为2:1
B. pH=2和pH=1的硝酸中c(H+)之比为1:2
C. 25 ℃时,0.1 mol·L-1CH3COOH的电离平衡常数K=2×10-5,则0.1 mol·L-1CH3COONa的水解平衡常数为5×10-10
D. 0.1 mol·L-1NaHCO3溶液中:c (Na+)+ c (H+)+ c (H2CO3)<c (HCO3-) +3 c (CO32-) + c (OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com