
【题目】设 NA 为阿伏加德罗常数的值,下列说法错误的是( )
A.标准状况下,80g SO3 所含的原子数为 4NA
B.过氧化钠与水反应时,生成 0.1molO2 转移的电子数为 0.2NA
C.1mol N2、3mol H2 混合反应,当生成 0.1mol NH3 时,转移电子数目为 0.3NA
D.100mL 0.1molL-1 的 Na2S 溶液,含有的阴离子数目为 0.01NA
【答案】D
【解析】
A.80g SO3的物质的量为![]() =1mol,所含原子数为4NA,故A不符合题意;
=1mol,所含原子数为4NA,故A不符合题意;
B.过氧化钠与水反应时,2Na2O2+2H2O=4NaOH+O2↑,氧元素化合价从-1价变化为-2价和0价,每生成0.1molO2 转移的电子数0.2mol,转移电子数为0.2NA,故B不符合题意;
C.1mol N2、3mol H2 混合反应,氮元素化合价从0价降低为-3价,当生成 0.1molNH3 时,转移电子数目为 0.3NA,故C不符合题意;
D.100mL 0.1molL-1 的 Na2S溶液中含0.01mol Na2S,S2-水解生成HS-、OH-,故阴离子数大于0.01NA,故D符合题意;
故答案为:D。


科目:高中化学 来源: 题型:
【题目】“84”消毒液(工业利用Cl2与NaOH反应制得)可用于消毒和漂白,下列实验现象的分析不正确的是
实验操作 |
|
|
|
实验现象 | 混合后溶液的pH=9.9,短时间内未褪色,一段时间后蓝色褪去。 | 混合后溶液pH=5.0,蓝色迅速褪去,无气体产生。 | 混合后溶液pH=3.2,蓝色迅速褪去,并产生大量气体,使湿润的淀粉碘化钾试纸变蓝。 |
A.对比实验①和②,②中蓝色迅速褪去的原因是发生了反应ClO+H+═HClO
B.实验③中产生的气体是Cl2,由HClO分解得到:2HClO═Cl2↑+H2O
C.对比实验②和③,溶液的pH可能会影响ClO的氧化性或Cl的还原性
D.加酸可以提高“84”消毒液的漂白效果,但需要调控合适的pH才能安全使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设 NA 为阿伏加德常数的数值,下列说法正确的是( )
A.18 g H2O 含有 10NA 个质子
B.1 mol 苯含有 3NA 个碳碳双键
C.标准状况下,22.4 L 氨水含有 NA 个 NH3 分子
D.常温下,112 g 铁片投入足量浓 H2SO4 中生成 3NA 个 SO2 分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是工业电解饱和食盐水的装置示意图,下列有关说法中不正确的是( )

A.装置中出口①处的物质是氯气,出口②处的物质是氢气
B.该离子交换膜只能让阳离子通过,不能让阴离子通过
C.装置中发生反应的离子方程式为Cl-+2H+![]() Cl2↑+H2↑
Cl2↑+H2↑
D.该装置是将电能转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工厂生产新型清洁燃料甲醚(CH3-O-CH3)的流水线反应原理为:在 10L 的反应容器内进行的反应①的化学平衡常数表达式为K=[CO][H2]/[H2O]。反应②的热化学方程式为:3H2(g)+3CO(g)CH3OCH3(g)+CO2(g)+Q。反应③为:CO2+NH3+H2O→NH4HCO3,完成下列填空:
(1)反应①的方程式为______。经3min反应容器内的水蒸气从20.0mol变为 2.0mol,则此 3min 内 CO 的平均反应速率V(CO)=______。
(2)能判断反应①已达化学平衡状态的是(选填编号)______。
A.在消耗 n 摩尔氢气的同时产生 n 摩尔的水
B.容器内气体的平均相对分子质量保持不变
C.容器内所有的物质的总物质的量保持不变
D.化学反应速率:V(逆)(H2O)=V(正)(CO)
(3)已知升高温度,反应②的化学平衡常数会减小,则反应②的热化学方程式中的Q(选填“>”或“<”)______0。该反应的逆反应速率V(逆)随时间 t 变化的关系如图一所示,则在 t2时改变的反应条件是______。
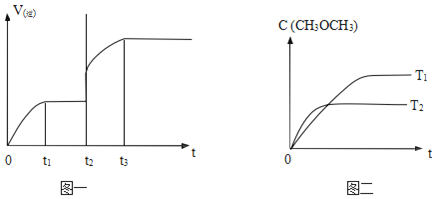
(4)在不同温度下,反应容器内甲醚(CH3OCH3)的浓度c(CH3OCH3)随时间t 变化的状况如图二所示。则反应温度 T1(选填“>”、“=”或“<”)______T2。
(5)若反应③得到的是一种纯净常见化肥的溶液。经测定溶液中也存在 NH3H2O 分子和CO32-离子,试用化学用语表示产生这两种微粒的原因:______,______。相同温度下,都为 0.1mol/L的 NaHCO3溶液甲和 NH4HCO3溶液乙相比较,溶液中c(CO32-)甲(选填“>”、“=”或“<”)甲______乙。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大运会时深圳新能源汽车上有一种质子交换膜燃料电池,工作原理如图所示,下列叙述正确的是( )
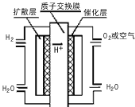
A.通入氧气的电极发生氧化反应
B.通入氢气的电极为正极
C.总反应式为O2+2H2![]() 2H2O
2H2O
D.正极的电极反应式为O2+4H++4e-=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,无水四氯化锡是一种无色易挥发、易流动的液体,遇水极易发生水解。某学习小组设计了下图所示的装置制备无水四氯化锡。其反应原理是 Sn(s)+2Cl2(g)=SnCl4(l) △H=-511kJ/mol
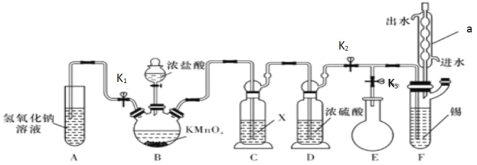
请回答下列问题:
(1)仪器 a 的名称是_____。
(2)装置 C 中所用试剂 X 是_____,装置 D 的作用是_____。
(3)装置 B 中发生反应的离子方程式是_____。
(4)利用该反应制取 Cl2 相对于用二氧化锰和浓盐酸反应的优点是:_____。
(5)若要制取5mol含氯气的物质的量分数为20%的SnCl4,则至少需通入的氯气(标准状况下)的体积为______
(6)上述实验设计中,还有一些不合理之处,请写出一点:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO和Cu(NO3)2,在所得溶液中加入1.0mol/L的NaOH溶液1.0L,此时溶液呈中性。金属离子已完全沉淀,沉淀质量为39.2g。下列有关说法不正确的是
A. Cu与Cu2O的物质的量之比为2∶1 B. 硝酸的物质的量浓度为2.6mol/L
C. 产生的NO在标准状况下的体积为4.48L D. Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO和Cu(NO3)2,在所得溶液中加入1.0mol/L的NaOH溶液1.0L,此时溶液呈中性。金属离子已完全沉淀,沉淀质量为39.2g。下列有关说法不正确的是
A. Cu与Cu2O的物质的量之比为2∶1 B. 硝酸的物质的量浓度为2.6mol/L
C. 产生的NO在标准状况下的体积为4.48L D. Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com