
【题目】常温下,无水四氯化锡是一种无色易挥发、易流动的液体,遇水极易发生水解。某学习小组设计了下图所示的装置制备无水四氯化锡。其反应原理是 Sn(s)+2Cl2(g)=SnCl4(l) △H=-511kJ/mol
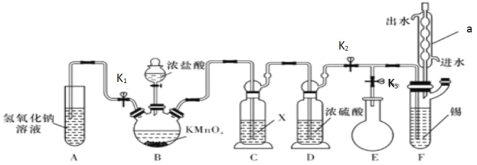
请回答下列问题:
(1)仪器 a 的名称是_____。
(2)装置 C 中所用试剂 X 是_____,装置 D 的作用是_____。
(3)装置 B 中发生反应的离子方程式是_____。
(4)利用该反应制取 Cl2 相对于用二氧化锰和浓盐酸反应的优点是:_____。
(5)若要制取5mol含氯气的物质的量分数为20%的SnCl4,则至少需通入的氯气(标准状况下)的体积为______
(6)上述实验设计中,还有一些不合理之处,请写出一点:_____。
【答案】球形冷凝管 饱和食盐水 干燥氯气 ![]() 该反应产生氯气速率较快,同时不需要加热,可减少HCl气体的挥发 201.6L 未进行尾气处理,冷凝管敞口,生成物易挥发或易水解,也没有对E装置进行冷却等
该反应产生氯气速率较快,同时不需要加热,可减少HCl气体的挥发 201.6L 未进行尾气处理,冷凝管敞口,生成物易挥发或易水解,也没有对E装置进行冷却等
【解析】
装置B制备氯气,C、D对氯气除杂干燥,E收集产物,F制备产物,
(1)根据仪器特点可得;
(2)用浓盐酸制备的氯气混有HCl和水蒸气,用饱和食盐水除去HCl,用浓硫酸吸水干燥;
(3)装置B由浓盐酸与高锰酸钾制备氯气,同时生成锰离子和水,据此书写;
(4)该反应化学反应速率较快,不需要加热,二氧化锰和浓盐酸反应制备氯气需要加热;
(5)5mol含氯气的物质的量分数为20%的SnCl4中氯气的物质的量为5mol×20%=1mol,其中的SnCl4含的氯元素相当于氯气的物质的量为2×5mol×80%=8mol,据此计算;
(6)该实验装置中未进行尾气处理,冷凝管敞口,生成物易挥发或易水解,也没有对E装置进行冷却等。
(1)仪器a为球形冷凝管,
故答案为:球形冷凝管;
(2)C的目的是除去氯气中的HCl气体,试剂X为饱和食盐水;产物易水解,故D装置中浓硫酸用来干燥氯气,
故答案为:饱和食盐水;干燥氯气;
(3)装置B由浓盐酸与高锰酸钾制备氯气,同时生成锰离子和水,离子方程式为:![]() ,
,
故答案为:![]() ;
;
(4)该反应产生氯气速率较快,同时不需要加热,可减少HCl气体的挥发,二氧化锰和浓盐酸反应制备氯气需要加热,
故答案为:该反应产生氯气速率较快,同时不需要加热,可减少HCl气体的挥发;
(5)5mol含氯气的物质的量分数为20%的SnCl4中氯气的物质的量为5mol×20%=1mol,其中的SnCl4含的氯元素相当于氯气的物质的量为2×5mol×80%=8mol,则所需要氯气至少9mol,标准状况下气体体积为9mol×22.4L/mol=201.6L,
故答案为:201.6L;
(6)该实验装置中未进行尾气处理,冷凝管敞口,生成物易挥发或易水解,也没有对E装置进行冷却等,
故答案为:未进行尾气处理,冷凝管敞口,生成物易挥发或易水解,也没有对E装置进行冷却等。


科目:高中化学 来源: 题型:
【题目】金刚烷是一种重要的化工原料,工业上可通过下列途径制备:

请回答下列问题:
(1)金刚烷的分子式为___________,其分子中的CH2基团有______个;
(2)如图是以环戊烷为原料制备环戊二烯的合成路线:

其中,反应④的方程式___________,反应④的反应类型是___________;
(3)已知烯烃能发生如下的反应: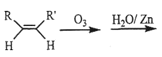 RCHO+R’CHO,请写出下列反应产物的结构简式:___________________。
RCHO+R’CHO,请写出下列反应产物的结构简式:___________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L固定容积的密闭容器中发生反应: 2N2O5(g)![]() 4NO2(g) + O2(g)ΔH>0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示。下列说法中正确的是
4NO2(g) + O2(g)ΔH>0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示。下列说法中正确的是
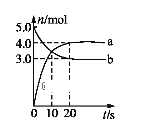
A.曲线a表示NO2的物质的量随反应时间的变化
B.0-20 s内平均反应速率v(N2O5) = 0.1 mol·(L·s)-1
C.10 s时,正、逆反应速率相等,达到平衡
D.20 s时,正反应速率大于逆反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设 NA 为阿伏加德罗常数的值,下列说法错误的是( )
A.标准状况下,80g SO3 所含的原子数为 4NA
B.过氧化钠与水反应时,生成 0.1molO2 转移的电子数为 0.2NA
C.1mol N2、3mol H2 混合反应,当生成 0.1mol NH3 时,转移电子数目为 0.3NA
D.100mL 0.1molL-1 的 Na2S 溶液,含有的阴离子数目为 0.01NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将0.1 mol·L-1氢氧化钠溶液与0.06 mol·L-1硫酸溶液等体积混合,该混合溶液的pH等于
A.1.7B.2.0C.12.0D.12.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: (1)Fe2O3(s)+![]() C(s)=
C(s)=![]() CO2(g)+2Fe(s),ΔH=+234.1kJmol-1
CO2(g)+2Fe(s),ΔH=+234.1kJmol-1
![]() 则
则![]() 的ΔH是( )
的ΔH是( )
A.-824.4 kJmol-1B.-627.6kJmol-1C.-744.7kJmol-1D.-169.4kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致该现象的主要原因是液滴之下氧气含量比边缘少。回答下列问题:

(1)液滴边缘是_______(填“正”或“负”)极区,发生的电极反应为____________________________。
(2)液滴中的Cl-由_______区向_______区迁移(填“b”或“a”)。
(3)在b区出现铁锈环的原因是液滴下的Fe因发生氧化反应而被腐蚀,生成的Fe2+_____________________进一步氧化、脱水形成铁锈。
(4)若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下图所示装置检验草酸亚铁晶体(FeC2O4·2H2O,淡黄色)受热分解的部分产物。下列说法正确的是( )
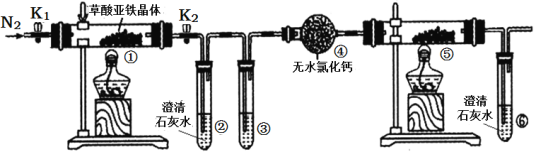
A. 通入N2的主要目的是防止空气中的水蒸气对产物检验产生影响
B. 若③和⑤中分别盛放足量NaOH溶液、CuO固体,可检验生成的CO
C. 实验结束后,①中淡黄色粉末完全变成黑色,则产物一定为铁
D. 若将④中的无水CaC12换成无水硫酸铜可检验分解生成的水蒸气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com