
【题目】一定温度下,在2 L固定容积的密闭容器中发生反应: 2N2O5(g)![]() 4NO2(g) + O2(g)ΔH>0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示。下列说法中正确的是
4NO2(g) + O2(g)ΔH>0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示。下列说法中正确的是
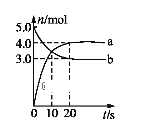
A.曲线a表示NO2的物质的量随反应时间的变化
B.0-20 s内平均反应速率v(N2O5) = 0.1 mol·(L·s)-1
C.10 s时,正、逆反应速率相等,达到平衡
D.20 s时,正反应速率大于逆反应速率
【答案】A
【解析】
A、在反应2N2O5(g)4NO2(g)+O2(g)中N2O5为反应物NO2为生成物,它们的计量数之比为1:2,也就是说NO2增加的物质的量是N2O5减小的物质的量的两倍,结合图中的数据可知曲线a表示NO2的物质的量随反应时间的变化,曲线b表示N2O5的物质的量随反应时间的变化,故A正确;
B、在反应2N2O5(g)4NO2(g)+O2(g)中N2O5为反应物NO2为生成物,它们的计量数之比为1:2,也就是说NO2增加的物质的量是N2O5减小的物质的量的两倍,所以曲线a表示NO2的物质的量随反应时间的变化,曲线b表示N2O5的物质的量随反应时间的变化,根据![]() =0.05 mol(Ls)-1,故B错误;
=0.05 mol(Ls)-1,故B错误;
C、根据图中可知10 s时反应物还在继续减小而生成物还在继续增大,所以此时反应还在正向进行,即正反应速率大于逆反应速率,故C错误;
D、根据图中反应物和生成物的物质的变化情况可知,20 s时有关物质的物质的量不再随时间的变化而变化,即反应处于平衡状态,此时正逆反应速率相等,,故D错误。
故答案为A。


科目:高中化学 来源: 题型:
【题目】以下是工业上制取纯硅的一种方法。

请回答下列问题(各元素用相应的元素符号表示):
(1)在上述生产过程中,属于置换反应的有____(填反应代号);
(2)写出反应③的化学方程式____;
(3)化合物W的用途很广,通常可用作建筑工业和造纸工业的黏合剂,可作肥皂的填充剂,是天然水的软化剂。将石英砂和纯碱按一定比例混合加热至1 373~1 623 K反应,生成化合物W,其化学方程式是____;
(4)A、B、C三种气体在“节能减排”中作为减排目标的一种气体是___(填化学式);分别通入W溶液中能得到白色沉淀的气体是___(填化学式);
(5)工业上合成氨的原料H2的制法是先把焦炭与水蒸气反应生成水煤气,再提纯水煤气得到纯净的H2,提纯水煤气得到纯净的H2的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】HBr是一种重要的工业原料,可以用来生产医用药品,合成染料或香料,用作石油化工的催化剂等。如图是工业制备HBr的一种生产流程:

(1)气体a是燃煤工业的烟道气和工业生产硫酸的尾气的成分,结合框图信息可判断气体a的分子式为___。混合物①中加的水为___(填“冰水”或“热水”),原因是___。
(2)试剂b为含氯的盐,b为___(用化学式表示),混合②的目的是___。第二次蒸馏后的“含c的溶液”中c为___。
(3)生产流程中操作A的名称___,实验室中蒸馏操作是在___中进行的。(填玻璃仪器名称)
(4)工业生产中制得的氢溴酸带有淡淡的黄色。于是甲、乙两同学设计了实验加以探究:①甲同学假设工业氢溴酸呈淡黄色是因为含有Fe3+,则用于证明该假设所用的试剂为___(填化学式),若假设成立可观察到的现象为___。
②乙同学假设工业氢溴酸呈淡黄色是因为其中含有杂质___,用于证明该假设成立的方法为___(简单写出实验步骤)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设 NA 为阿伏加德常数的数值,下列说法正确的是( )
A.18 g H2O 含有 10NA 个质子
B.1 mol 苯含有 3NA 个碳碳双键
C.标准状况下,22.4 L 氨水含有 NA 个 NH3 分子
D.常温下,112 g 铁片投入足量浓 H2SO4 中生成 3NA 个 SO2 分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是( )
A.向盐酸中加入氨水至中性,溶液中 >1
>1
B.醋酸溶液和氢氧化钠溶液恰好反应,溶液中![]() >1
>1![]()
C.向0.1molL-1CH3COOH溶液中加入少量水,溶液中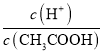 减小
减小
D.将CH3COONa溶液从20℃升温至30℃,溶液中![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是工业电解饱和食盐水的装置示意图,下列有关说法中不正确的是( )

A.装置中出口①处的物质是氯气,出口②处的物质是氢气
B.该离子交换膜只能让阳离子通过,不能让阴离子通过
C.装置中发生反应的离子方程式为Cl-+2H+![]() Cl2↑+H2↑
Cl2↑+H2↑
D.该装置是将电能转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工厂生产新型清洁燃料甲醚(CH3-O-CH3)的流水线反应原理为:在 10L 的反应容器内进行的反应①的化学平衡常数表达式为K=[CO][H2]/[H2O]。反应②的热化学方程式为:3H2(g)+3CO(g)CH3OCH3(g)+CO2(g)+Q。反应③为:CO2+NH3+H2O→NH4HCO3,完成下列填空:
(1)反应①的方程式为______。经3min反应容器内的水蒸气从20.0mol变为 2.0mol,则此 3min 内 CO 的平均反应速率V(CO)=______。
(2)能判断反应①已达化学平衡状态的是(选填编号)______。
A.在消耗 n 摩尔氢气的同时产生 n 摩尔的水
B.容器内气体的平均相对分子质量保持不变
C.容器内所有的物质的总物质的量保持不变
D.化学反应速率:V(逆)(H2O)=V(正)(CO)
(3)已知升高温度,反应②的化学平衡常数会减小,则反应②的热化学方程式中的Q(选填“>”或“<”)______0。该反应的逆反应速率V(逆)随时间 t 变化的关系如图一所示,则在 t2时改变的反应条件是______。
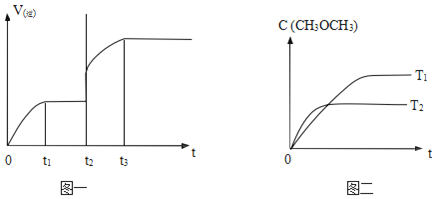
(4)在不同温度下,反应容器内甲醚(CH3OCH3)的浓度c(CH3OCH3)随时间t 变化的状况如图二所示。则反应温度 T1(选填“>”、“=”或“<”)______T2。
(5)若反应③得到的是一种纯净常见化肥的溶液。经测定溶液中也存在 NH3H2O 分子和CO32-离子,试用化学用语表示产生这两种微粒的原因:______,______。相同温度下,都为 0.1mol/L的 NaHCO3溶液甲和 NH4HCO3溶液乙相比较,溶液中c(CO32-)甲(选填“>”、“=”或“<”)甲______乙。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,无水四氯化锡是一种无色易挥发、易流动的液体,遇水极易发生水解。某学习小组设计了下图所示的装置制备无水四氯化锡。其反应原理是 Sn(s)+2Cl2(g)=SnCl4(l) △H=-511kJ/mol
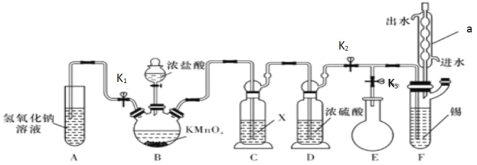
请回答下列问题:
(1)仪器 a 的名称是_____。
(2)装置 C 中所用试剂 X 是_____,装置 D 的作用是_____。
(3)装置 B 中发生反应的离子方程式是_____。
(4)利用该反应制取 Cl2 相对于用二氧化锰和浓盐酸反应的优点是:_____。
(5)若要制取5mol含氯气的物质的量分数为20%的SnCl4,则至少需通入的氯气(标准状况下)的体积为______
(6)上述实验设计中,还有一些不合理之处,请写出一点:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由菱镁矿(主要成分为MgCO3、CaCO3、FeCO3、SiO2)制备高纯Mg(OH)2的一种工艺如下:
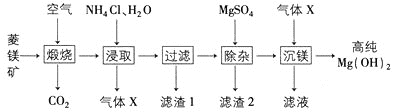
下列说法不正确的是
A.“煅烧”时FeCO3发生反应为4FeCO3+O2![]() 2Fe2O3+4CO2
2Fe2O3+4CO2
B.“浸取”产生的气体X为NH3
C.“滤渣1”“滤渣2”分别为SiO2、CaSO4
D.“沉镁”所得的固体是否洗涤干净可用BaCl2溶液检验
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com