
【题目】金刚烷是一种重要的化工原料,工业上可通过下列途径制备:

请回答下列问题:
(1)金刚烷的分子式为___________,其分子中的CH2基团有______个;
(2)如图是以环戊烷为原料制备环戊二烯的合成路线:

其中,反应④的方程式___________,反应④的反应类型是___________;
(3)已知烯烃能发生如下的反应: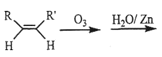 RCHO+R’CHO,请写出下列反应产物的结构简式:___________________。
RCHO+R’CHO,请写出下列反应产物的结构简式:___________________。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】下列反应中符合图像的是

A.2SO3(g) ![]() 2SO2(g)+O2(g) △H=+Q2kJ·mol-1(Q2>0)
2SO2(g)+O2(g) △H=+Q2kJ·mol-1(Q2>0)
B.H2(g)+CO(g) ![]() C(s)+H2O(g) △H=+Q4kJ·mol-1(Q4>0)
C(s)+H2O(g) △H=+Q4kJ·mol-1(Q4>0)
C.N2(g)+3H2(g) ![]() 2NH3(g) △H =-Q1kJ·mol-1 (Q1>0)
2NH3(g) △H =-Q1kJ·mol-1 (Q1>0)
D.4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g) △H =-Q3kJ·mol-1 (Q3>0)
4NO(g)+6H2O(g) △H =-Q3kJ·mol-1 (Q3>0)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是工业上制取纯硅的一种方法。

请回答下列问题(各元素用相应的元素符号表示):
(1)在上述生产过程中,属于置换反应的有____(填反应代号);
(2)写出反应③的化学方程式____;
(3)化合物W的用途很广,通常可用作建筑工业和造纸工业的黏合剂,可作肥皂的填充剂,是天然水的软化剂。将石英砂和纯碱按一定比例混合加热至1 373~1 623 K反应,生成化合物W,其化学方程式是____;
(4)A、B、C三种气体在“节能减排”中作为减排目标的一种气体是___(填化学式);分别通入W溶液中能得到白色沉淀的气体是___(填化学式);
(5)工业上合成氨的原料H2的制法是先把焦炭与水蒸气反应生成水煤气,再提纯水煤气得到纯净的H2,提纯水煤气得到纯净的H2的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84”消毒液(工业利用Cl2与NaOH反应制得)可用于消毒和漂白,下列实验现象的分析不正确的是
实验操作 |
|
|
|
实验现象 | 混合后溶液的pH=9.9,短时间内未褪色,一段时间后蓝色褪去。 | 混合后溶液pH=5.0,蓝色迅速褪去,无气体产生。 | 混合后溶液pH=3.2,蓝色迅速褪去,并产生大量气体,使湿润的淀粉碘化钾试纸变蓝。 |
A.对比实验①和②,②中蓝色迅速褪去的原因是发生了反应ClO+H+═HClO
B.实验③中产生的气体是Cl2,由HClO分解得到:2HClO═Cl2↑+H2O
C.对比实验②和③,溶液的pH可能会影响ClO的氧化性或Cl的还原性
D.加酸可以提高“84”消毒液的漂白效果,但需要调控合适的pH才能安全使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂。请填写下列空白:
(1)滴定终点的判断:溶液由_____________。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是(_____)
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用盐酸溶液的体积为_________mL。

(4)某学生根据3次实验分别记录有关数据如表:
滴定 次数 | 待测NaOH溶液的体积/mL | 0.1000 mol/L盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 平均耗用盐酸 体积/mL | ||
第一次 | 25.00 | 0.00 | 26.15 | ①V=__________ |
第二次 | 25.00 | 0.56 | 30.30 | |
第三次 | 25.00 | 0.20 | 26.35 | |
②依据上表数据计算该NaOH溶液的物质的量浓度________ (计算结果取4位有效数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸铝是一种不溶于水和醇,溶于强酸的白色粉末,是重要的媒染剂。某化学兴趣小组设计实验从废弃铝—空气海水电池中回收铝并制备草酸铝晶体。
【实验过程】
(一)铝的回收
①称取16.0g废弃电池原料;
②用98.3%的硫酸进行酸浸、稀释、除杂、过滤;
③将滤液蒸干得到硫酸铝固体mlg.
(二)草酸铝的制备
④配制250mL0.20mol/L的硫酸铝溶液;
⑤量取0.10mol/L的草酸铵溶液20.00mL,并加入一定量的分散剂,缓缓加入配制的硫酸铝溶液25.00mL,搅拌lh;
⑥沉化、抽滤、洗涤、干燥、称量固体质量为m2g。
【问题讨论】
(1)在用98.3%的硫酸进行酸浸时,浸出率与条件的关系如图所示:

由图可知浓硫酸为浸取剂的最佳条件为________。
(2)步骤③蒸干溶液所需的仪器有带铁圈的铁架台、酒精灯、_______、_______。
(3)铝的回收率为_______ (回收率=回收铝的质量/原料的质量)。
(4)步骤⑥中洗涤晶体时先用蒸馏水再用乙醇洗涤,这样洗涤的原因是_______。
(5)该研究小组在实验过程中发现,若用0.90mol/L草酸铵进行实验,会导致沉淀的质量远超过实际草酸铝的质量。经分析,结晶生成物为(NH4)xAly(C2O4)z·nH2O。 现称取3.990g该结晶水合物进行热分解,得到剩余固体的质量随温度变化的曲线如下图所示。己知450℃时剩余固体只有Al2O3。第II阶段共产生气体2.016L (标准状况),该气体通入足量的石灰水中产生3.000g沉淀。请计算求出该结晶水合物的化学式为______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】HBr是一种重要的工业原料,可以用来生产医用药品,合成染料或香料,用作石油化工的催化剂等。如图是工业制备HBr的一种生产流程:

(1)气体a是燃煤工业的烟道气和工业生产硫酸的尾气的成分,结合框图信息可判断气体a的分子式为___。混合物①中加的水为___(填“冰水”或“热水”),原因是___。
(2)试剂b为含氯的盐,b为___(用化学式表示),混合②的目的是___。第二次蒸馏后的“含c的溶液”中c为___。
(3)生产流程中操作A的名称___,实验室中蒸馏操作是在___中进行的。(填玻璃仪器名称)
(4)工业生产中制得的氢溴酸带有淡淡的黄色。于是甲、乙两同学设计了实验加以探究:①甲同学假设工业氢溴酸呈淡黄色是因为含有Fe3+,则用于证明该假设所用的试剂为___(填化学式),若假设成立可观察到的现象为___。
②乙同学假设工业氢溴酸呈淡黄色是因为其中含有杂质___,用于证明该假设成立的方法为___(简单写出实验步骤)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设 NA 为阿伏加德常数的数值,下列说法正确的是( )
A.18 g H2O 含有 10NA 个质子
B.1 mol 苯含有 3NA 个碳碳双键
C.标准状况下,22.4 L 氨水含有 NA 个 NH3 分子
D.常温下,112 g 铁片投入足量浓 H2SO4 中生成 3NA 个 SO2 分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,无水四氯化锡是一种无色易挥发、易流动的液体,遇水极易发生水解。某学习小组设计了下图所示的装置制备无水四氯化锡。其反应原理是 Sn(s)+2Cl2(g)=SnCl4(l) △H=-511kJ/mol
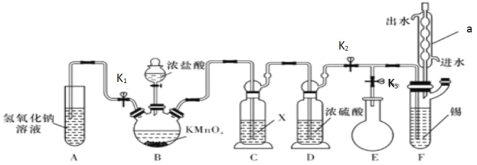
请回答下列问题:
(1)仪器 a 的名称是_____。
(2)装置 C 中所用试剂 X 是_____,装置 D 的作用是_____。
(3)装置 B 中发生反应的离子方程式是_____。
(4)利用该反应制取 Cl2 相对于用二氧化锰和浓盐酸反应的优点是:_____。
(5)若要制取5mol含氯气的物质的量分数为20%的SnCl4,则至少需通入的氯气(标准状况下)的体积为______
(6)上述实验设计中,还有一些不合理之处,请写出一点:_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com