
����Ŀ��ijѧ��������֪���ʵ���Ũ�ȵ��������ⶨδ֪���ʵ���Ũ�ȵ�NaOH��Һʱ��ѡ���̪��ָʾ��������д���пհף�
��1���ζ��յ���жϣ���Һ��_____________��
��2�����в����п���ʹ����NaOH��Һ��Ũ����ֵƫ�͵�����_____��
A����ʽ�ζ���δ�ñ�������ϴ��ֱ��ע�������
B���ζ�ǰʢ��NaOH��Һ����ƿ������ˮϴ����û�и���
C����ʽ�ζ����ڵζ�ǰ�����ݣ��ζ���������ʧ
D����ȡ�������ʱ����ʼ���Ӷ������ζ�����ʱ���Ӷ���
��3�����ζ���ʼ�ͽ���ʱ����ʽ�ζ����е�Һ����ͼ��ʾ��������������Һ�����Ϊ_________mL��

��4��ijѧ������3��ʵ��ֱ��¼�й����������
�ζ� ���� | ����NaOH��Һ�����/mL | 0.1000 mol/L��������/mL | ||
�ζ�ǰ�̶� | �ζ���̶� | ƽ���������� ���/mL | ||
��һ�� | 25.00 | 0.00 | 26.15 | ��V=__________ |
�ڶ��� | 25.00 | 0.56 | 30.30 | |
������ | 25.00 | 0.20 | 26.35 | |
�������ϱ����ݼ����NaOH��Һ�����ʵ���Ũ��________ (������ȡ4λ��Ч��)��
���𰸡���Һǡ����dz��ɫ�����ɫ���Ұ�����ڲ��ָ���ɫ D 26.10 27.35 0.1046mol/l
��������
(1)�������̪��죬������̪����ɫ�����Եζ��յ�ʱ��Һ����ɫ�仯ӦΪ��dz��ɫ�����ɫ��
(2)����c(��)=![]() ����
����
A����ʽ�ζ���δ�ñ�������ϴ��ֱ��ע������ᣬ��������������
B���ζ�ǰʢ��NaOH��Һ����ƿ������ˮϴ����û�и����Ӱ�죻
C����ʽ�ζ����ڵζ�ǰ�����ݣ��ζ���������ʧ����ȡ����������
D����ȡ�������ʱ����ʼ���Ӷ���������ƫС���ζ�����ʱ���Ӷ���������ƫ�����ֵ
ƫС������ȡ������������ƫС��
(3)��ͼ��֪����ʼV=0.20mL������ʱV=26.30mL��������������Һ�����Ϊ26.30mL-0.20mL��
(4)��������������Һ�������֪��ƽ��ֵΪ![]() ��
��
�ڸ������ݵ���Ч�ԣ���ȥ��2�����ݣ�Ȼ�����1��3��ƽ������V(����)=26.15mL����c(��)=![]() ����������⡣
����������⡣
(1)�������̪��죬�ζ��յ�ʱ�۲���ƿ����Һ����ɫ��dz��ɫ�����ɫ���Ұ�����ڲ��ָ���ɫ����ﵽ�ζ��յ㡣��Ϊ����Һǡ����dz��ɫ�����ɫ���Ұ�����ڲ��ָ���ɫ��
(2)��c(��)=![]() ��֪��
��֪��
A����ʽ�ζ���δ�ñ�������ϴ��ֱ��ע������ᣬ����������������c(��)ƫ��A�������⣻
B���ζ�ǰʢ��NaOH��Һ����ƿ������ˮϴ����û�и����Ӱ�죬B�������⣻
C����ʽ�ζ����ڵζ�ǰ�����ݣ��ζ���������ʧ������������������c(��)ƫ��C�������⣻
D����ȡ�������ʱ����ʼ���Ӷ���������ƫС���ζ�����ʱ���Ӷ���������ƫ�����ֵƫС������ȡ������������ƫС������c(��)ƫ�ͣ�D�������⡣
����D��
(3)��ͼ��֪����ʼV=0.20mL������ʱV=26.30mL��������������Һ�����Ϊ26.30mL-0.20mL=26.10mL����Ϊ��26.10��
(4)��������������Һ�������֪��ƽ��ֵΪ![]() =27.35mL����Ϊ��27.35��
=27.35mL������27.35��
�ڸ������ݵ���Ч�ԣ���ȥ��2�����ݣ�Ȼ�����1��3��ƽ������V(����)=26.15mL����c(��)=![]() ��֪��c(��)=
��֪��c(��)=![]() =0.1046mol/l��
=0.1046mol/l��
����0.1046mol/l��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ������I�̶��������������������ƶ���M��N���������о�������Ӧ��A(g)+2B(g)![]() xC(g)��H=��192kJmol��1����M��N�ж�ͨ��1mol A��2mol B�Ļ�����壬��ʼM��N�ݻ���ͬ�������¶Ȳ��䣮����˵����ȷ����( )
xC(g)��H=��192kJmol��1����M��N�ж�ͨ��1mol A��2mol B�Ļ�����壬��ʼM��N�ݻ���ͬ�������¶Ȳ��䣮����˵����ȷ����( )

A. ��x=3���ﵽƽ���A�����������ϵΪ����(M)����(N)
B. ��x��3���ﵽƽ���B��ת���ʹ�ϵΪ����(M)����(N)
C. ��x��3��C��ƽ��Ũ�ȹ�ϵΪ��c(M)��c(N)
D. x����Ϊ��ֵ����ʼʱ��N�����г�������ֵ��C��ƽ���N������A��Ũ�Ⱦ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2molNaHCO3��һ������Na2O2�����ϣ��ڼ��ȵ�������ʹ�䷴Ӧ�����ⶨ��Na2O2ʣ�࣬��������ù�������ʵ�����n��Ϊ
A.1mol��n��2molB.1mol��n��4molC.2mol��n��4molD.n��4mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ú�ת��PCl5��NO2��SO2��CO��NO����Ⱦ�������ǻ����������Ҫ���⡣
��1����֪��P4(s) + 6Cl2(g) = 4PCl3(g) ��H1= c kJmol-1
P4(s) +10Cl2(g) = 4PCl5(g) ��H2= d kJmol-1
PCl3��PCl5���ӵĽṹ��ͼ������ʵ�߱�ʾ��ѧ�������Ͽ�PCl5������1mol P-Cl����ƽ������x kJ���������Ͽ�PCl3��1mol P-Cl������1.2x kJ��������
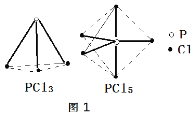
��д��PCl3��Cl2��Ӧ���Ȼ�ѧ����ʽ_______������ֵ��c��d��ʾ��
�ڶϿ�1mol��Cl-Cl�����ĵ�����Ϊ________��
��2��NOx���ŷ���Ҫ����������β�������÷�Ӧ��C(s)+2NO(g)![]() N2(g)+CO2(g) ��H = -34.0 kJmol-1 ���û���̿��NO������������֪�ں�ѹ�ܱ������м���������C��һ������NO���壬���NO��ת�������¶ȵı仯��ͼ2��ʾ��
N2(g)+CO2(g) ��H = -34.0 kJmol-1 ���û���̿��NO������������֪�ں�ѹ�ܱ������м���������C��һ������NO���壬���NO��ת�������¶ȵı仯��ͼ2��ʾ��
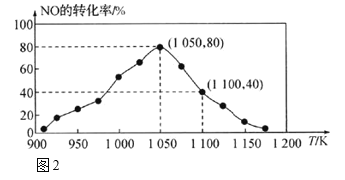
����ͼ2��֪����Ӧ���¶�1050K֮ǰ��NO��ת�������¶����߶�������ԭ����_______����1100Kʱ��CO2���������Ϊ___��
�������ʵ�ƽ���ѹ���������ʵ���Ũ��Ҳ���Ա�ʾ��ѧƽ�ⳣ��������Kp������1050K��1.1��106Paʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ��Kp=________��[��֪�������ѹP��=������ѹ(P��)���������ʵ�������]
��3����ӦN2O4(g)![]() 2NO2(g) ��H > 0 ����һ��������N2O4��NO2��������������Եķ�ѹ�����¹�ϵ����(N2O4)=k1��p(N2O4)����(NO2)=k2��p2(NO2)������k1��k2�����¶��йصij�������Ӧ��������N2O4��NO2�ķ�ѹ��ϵ��ͼ3��ʾ��
2NO2(g) ��H > 0 ����һ��������N2O4��NO2��������������Եķ�ѹ�����¹�ϵ����(N2O4)=k1��p(N2O4)����(NO2)=k2��p2(NO2)������k1��k2�����¶��йصij�������Ӧ��������N2O4��NO2�ķ�ѹ��ϵ��ͼ3��ʾ��
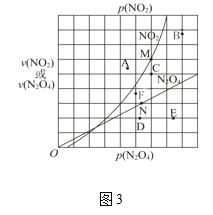
����T��ʱ��ͼ3��M��N���ܱ�ʾ�÷�Ӧ�ﵽƽ��״̬��������________��
�ڸı��¶ȣ���(NO2)����M���ΪA��B��C����(N2O4)����N���ΪD��E��F�������ߵ�ijһ�¶�ʱ����Ӧ���´ﵽƽ�⣬NO2��N2O4���Ӧ�ĵ�ֱ���___�� ___������ĸ��
��4���ݱ������Զ�����̼Ϊԭ�ϲ�������ĵ缫���ǿ���ԵĶ�����̼ˮ��Һ�ɵõ�����ȼ�ϣ���ԭ����ͼ4��ʾ��
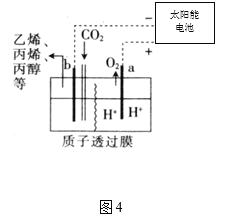
��a������________(����������������ԭ��)��Ӧ��
�ڵ��ʱ��b����������ϩ�ĵ缫��ӦΪ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ǵ�ͳ�в�ҩ�ƴ����Ч�ɷ�֮һ����ṹ��ͼ��ʾ�����ɱ������ϸ���ж������á� �����йغ����ص�������ȷ����

A. �����ʷ���������ԭ���п�����ͬһƽ����
B. �������صķ���ʽΪC16H1305
C. 1mol������������2 mol Br2�����ӳɷ�Ӧ
D. ������H�����ӳɷ�Ӧ�÷����й����ŵ��������2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������һ����Ҫ�Ļ���ԭ�ϣ���ҵ�Ͽ�ͨ������;���Ʊ���

��ش��������⣺
��1�������ķ���ʽΪ___________��������е�CH2������______����
��2����ͼ���Ի�����Ϊԭ���Ʊ������ϩ�ĺϳ�·�ߣ�

���У���Ӧ�ܵķ���ʽ___________����Ӧ�ܵķ�Ӧ������___________��
��3����֪ϩ���ܷ������µķ�Ӧ��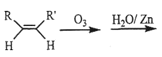 RCHO+R��CHO,��д�����з�Ӧ����Ľṹ��ʽ��___________________��
RCHO+R��CHO,��д�����з�Ӧ����Ľṹ��ʽ��___________________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������еĵ�����ϳɰ���ά�ֵ����������������ת�����̣�����ҹ��ɹ����Ƴ���Ч����̵�����Mo2N���������Ƴɹ�����Ч��ߵ�������Ч�ʡ�
�ش��������⣺
��1����(Mo)λ�ڵ������ڣ����ͬ���壬��Mo�ļ۵����Ų�ʽΪ______________��
��2����̬��ԭ�Ӻ�����ӿռ��˶�״̬��____�֣���Ԫ�����������е�һ����������ǰ����Ԫ��������____�����ɴ�С��˳��д����
��3����Ԫ�����γ�һϵ�еĻ������NH3��HN3���ṹʽΪ![]() ����H2NCH2COOH�ȡ�NH3�ķ��ӹ���Ϊ________��HN3�ṹʽ�м�������ԭ�ӵ��ӻ��������Ϊ________��1��HN3�����к�______��������H2NCH2COOH���۵�Ϊ182 �棩��CH3CH2COOH���۵�Ϊ22 �棩����Է�������������ͬ�����۵����ܴ����ʽṹ�ĽǶȷ��������¸��������Ҫԭ����______��
����H2NCH2COOH�ȡ�NH3�ķ��ӹ���Ϊ________��HN3�ṹʽ�м�������ԭ�ӵ��ӻ��������Ϊ________��1��HN3�����к�______��������H2NCH2COOH���۵�Ϊ182 �棩��CH3CH2COOH���۵�Ϊ22 �棩����Է�������������ͬ�����۵����ܴ����ʽṹ�ĽǶȷ��������¸��������Ҫԭ����______��
��4�����벬Ԫ���γɵ�ij�ֻ����ᄃ����ͼ��ʾ����û�����Ļ�ѧʽΪ______�����þ����ı߳�Ϊd pm��������ܶ�Ϊ____ g/cm3��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״����ǻ����л�����ԭ�ϣ��ֿ���Ϊȼ�������������ȼ�ϡ�
��1����ҵ�Ϻϳɼ״��ķ�ӦΪ��CO(g)+2H2(g)![]() CH3OH(g) ��H���±����������Ǹ÷�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ����K����
CH3OH(g) ��H���±����������Ǹ÷�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ����K����
�¶� | 250�� | 300�� | 350�� |
ƽ�ⳣ��K | 2.041 | 0.270 | 0.012 |
�ɱ��������жϸ÷�ӦΪ ________��Ӧ�������������������������� ij�¶��£���2 molCO��6 molH2����2 L���ܱ������г�ַ�Ӧ���ﵽƽ����c(CO)��0.2 mol/L����CO��ת����Ϊ______����ʱ���¶�Ϊ______���ӱ���ѡ��
��2����֪�ڳ��³�ѹ�£�
��2CH3OH(l)+3O2(g)��2CO2(g)+4H2O(g) ��H1kJ/mol
��2CO(g)+O2(g)��2CO2(g) ��H2kJ/mol
��H2O(g)��H2O(l) ��H3kJ/mol
��ӦCH3OH(l)+O2(g)��CO(g)+2H2O(l) ��H�� _____________ kJ/mol������H1����H2����H3��ʾ����
��3�����Լ״�ȼ�ϵ�أ����õ�ⷨ���������Ժ�����ˮ����Ҫ����Cr2O72��ʱ��ʵ����������ͼװ��ģ��÷���

��N�缫�ĵ缫��ӦʽΪ ___________________________________��
������ɵ�����Cr2O72ת��ΪCr3+�����ӷ�Ӧ����ʽ��
Cr2O72 + ______ Fe2+ + ______ �� ______ Cr3+ + ______ Fe3+ + ______
��4��������ˮʱ�����Cr3+��Cr(OH)3��ʽ��ȥ����c(Cr3+)��1��105 mol/Lʱ��Cr3+������ȫ����ʱ��Һ��pH��______������֪��Ksp=6.4��1031��lg2=0.3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.1 mol��L��1����������Һ��0.06 mol��L��1������Һ�������ϣ��û����Һ��pH����
A.1.7B.2.0C.12.0D.12.4
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com