
【题目】对于反应3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)的平衡常数,下列说法正确的是
Fe3O4(s)+4H2(g)的平衡常数,下列说法正确的是
A.增大H2O(g)的浓度或减小H2的浓度,会使平衡常数减小
B.改变反应的温度,平衡常数不一定变化
C.K=![]()
D.K=![]()
科目:高中化学 来源: 题型:
【题目】通过传感器可以监测空气中甲醛的含量。一种燃料电池型甲醛气体传感器的原理如图所示,下列说法错误的是

A. a为电池的正极,发生还原反应
B. b极的电极反应为HCHO+H2O-4e-==CO2+4H+
C. 传感器工作过程中,电解质溶液中硫酸的浓度减小
D. 当电路中转移2×10-4 mol电子时,传感器内参加反应的HCHO为3.0 mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型陶瓷材料氮化硅(Si3N4)可用于制作火箭发动机中燃料的喷嘴。氮化硅可由石英、焦炭在高温氮气流中制取。完成下列填空:______SiO2+______C+______N2![]() ______Si3N4+______CO。
______Si3N4+______CO。
(1)试配平该化学反应方程式,将系数填写在对应位置上。在方程式上标出电子转移的方向和数目。____________
(2)反应中______被还原,当氧化产物比还原产物多 1mol 时,反应中电子转移数为______。
(3)在该反应体系中:所涉及物质属于非极性分子的电子式为______;所涉及元素中原子半径最大的原子的最外层电子排布式为______。
(4)反应的主要产物氮化硅所属的晶体类型为______,证明氮化硅组成元素非金属性强弱:
(Ⅰ)写出一个化学事实______;
(Ⅱ)从原子结构上进行说明:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容容器中发生N2O4(g)2NO2(g),若反应物的浓度由0.1molL﹣1降到0.06molL﹣1需20s,那么由0.06molL﹣1降到0.036molL﹣1,所需反应时间为( )
A. 10 sB. 12 sC. 大于12 sD. 小于12 s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: (1)Fe2O3(s)+![]() C(s)=
C(s)=![]() CO2(g)+2Fe(s),ΔH=+234.1kJmol-1
CO2(g)+2Fe(s),ΔH=+234.1kJmol-1
![]() 则
则![]() 的ΔH是( )
的ΔH是( )
A.-824.4 kJmol-1B.-627.6kJmol-1C.-744.7kJmol-1D.-169.4kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.NaClO溶液与FeCl2溶液混合:Fe2++2ClO-+2H2O===Fe(OH)2↓ + 2HClO
B.苯酚钠溶液中通入少量CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3-
C.澄清石灰水与过量NaHCO3溶液反应:HCO3-+Ca2++OH-===CaCO3↓+H2O
D.铵明矾[NH4Al(SO4)2·12H2O]溶液中加入过量Ba(OH)2溶液: Al3++2(SO4)2-+2Ba2++4OH-===AlO2-+2BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:2H2(g)+O2(g) ![]() 2H2O(l) H= -571.6 kJ·mol-1,2CH3OH(l)+3O2(g)
2H2O(l) H= -571.6 kJ·mol-1,2CH3OH(l)+3O2(g) ![]() 2CO2(g)+4H2O(l) H= -1452 kJ·mol-1,H+(aq)+OH-(aq)
2CO2(g)+4H2O(l) H= -1452 kJ·mol-1,H+(aq)+OH-(aq) ![]() H2O(l) H= -57.3 kJ·mol-1。据此判断下列说法正确的是
H2O(l) H= -57.3 kJ·mol-1。据此判断下列说法正确的是
A. CH3OH的燃烧热为1452 kJ·mol-1
B. 2H2(g)+O2(g) ![]() 2H2O(g) H > -571.6 kJ·mol-1
2H2O(g) H > -571.6 kJ·mol-1
C. CH3COOH(aq)+NaOH(aq) ![]() H2O(l)+CH3COONa(aq) H= -57.3 kJ·mol-1
H2O(l)+CH3COONa(aq) H= -57.3 kJ·mol-1
D. 2CH3OH(l)+O2(g) ![]() 2CO2(g)+4H2(g) H= -880.4 kJ·mol-1
2CO2(g)+4H2(g) H= -880.4 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为探究![]() 溶液和不同类型盐溶液反应的多样性,设计如图实验:
溶液和不同类型盐溶液反应的多样性,设计如图实验:

已知:AgSCN为白色难溶物。
下列说法不正确的是( )
A.①中的白色沉淀是![]()
B.向①的试管中滴加![]() KI溶液,有黄色沉淀生成证明存在
KI溶液,有黄色沉淀生成证明存在![]()
C.②中发生了氧化还原反应
D.对于③中红色褪去的原因可能与平衡移动原理有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾天气严重影响人们的生活质量,其中氮氧化物和硫氧化物是造成雾霾天气的主要原因之一。消除氮氧化物和硫氧化物有多种方法。
(1)氮、氧元素非金属性较强的是_____。(用元素符号回答)
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图1所示:
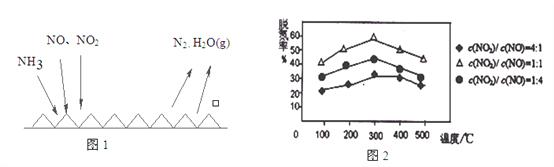
①由图1可知SCR技术中的氧化剂为:_________________。
②用Fe做催化剂时,在氨气足量的情况下,不同c(NO)/c(NO2)对应的脱氮率如图2所示,效果最佳的c(NO)/ c(NO2)=_________。
(3)硝酸厂常用如下烧碱吸收法处理氦氧化物(NO与NO2)尾气。氮氧化物(NO与NO2)用烧碱进行吸收,产物为NaNO2、NaNO3和H2O。现有含0.5mol氮氧化物的尾气,恰好被一定体积的25%NaOH溶液(密度1.28g/cm3)完全吸收。已知反应后溶液中含有0.35mo1NaNO2。则尾气中NO与NO2的物质的量之比为______。(已知:2NO2+2NaOH=NaNO3+NaNO2+H2O、NO+NO2+2NaOH=2NaNO2+H2O)
(4)现将一定量的铁和铜的混合物分为等质量的4份,分别加入等浓度不同体积的稀硝酸[假设反应中稀硝酸的还原产物只有NO),产生气体在标准状况下的体积与剩余固体的质量如下表:
硝酸体枳(mL) | 100 | 200 | 300 | 400 |
剩余固体(g) | 18.0 | 9.6 | 0 | 0 |
放出气体的体积(mL) | 2240 | 4480 | 6720 |
计算原混合物中铁和铜的物质的量比为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com