
【题目】雾霾天气严重影响人们的生活质量,其中氮氧化物和硫氧化物是造成雾霾天气的主要原因之一。消除氮氧化物和硫氧化物有多种方法。
(1)氮、氧元素非金属性较强的是_____。(用元素符号回答)
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图1所示:
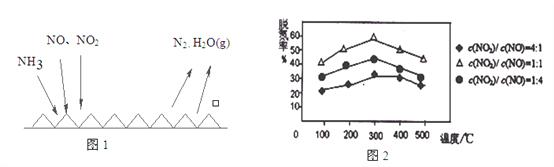
①由图1可知SCR技术中的氧化剂为:_________________。
②用Fe做催化剂时,在氨气足量的情况下,不同c(NO)/c(NO2)对应的脱氮率如图2所示,效果最佳的c(NO)/ c(NO2)=_________。
(3)硝酸厂常用如下烧碱吸收法处理氦氧化物(NO与NO2)尾气。氮氧化物(NO与NO2)用烧碱进行吸收,产物为NaNO2、NaNO3和H2O。现有含0.5mol氮氧化物的尾气,恰好被一定体积的25%NaOH溶液(密度1.28g/cm3)完全吸收。已知反应后溶液中含有0.35mo1NaNO2。则尾气中NO与NO2的物质的量之比为______。(已知:2NO2+2NaOH=NaNO3+NaNO2+H2O、NO+NO2+2NaOH=2NaNO2+H2O)
(4)现将一定量的铁和铜的混合物分为等质量的4份,分别加入等浓度不同体积的稀硝酸[假设反应中稀硝酸的还原产物只有NO),产生气体在标准状况下的体积与剩余固体的质量如下表:
硝酸体枳(mL) | 100 | 200 | 300 | 400 |
剩余固体(g) | 18.0 | 9.6 | 0 | 0 |
放出气体的体积(mL) | 2240 | 4480 | 6720 |
计算原混合物中铁和铜的物质的量比为_______________。
【答案】 O NO、NO2 1:1 1:4 2:1
【解析】分析:(1)根据元素周期表中的规律知识来回答;
(2)①得电子化合价降低的反应物是氧化剂;
②根据纵坐标判断,相同温度下,脱氢率越高的效果越好;
(3)根据原子守恒计算;
(4)根据表中数据可判断前两次实验中金属过量,结合金属的性质、反应的先后顺序以及守恒法计算。
详解:(1)同周期元素的原子的得电子能力(元素的非金属性)从左到右逐渐增强,氮、氧元素非金属性较强的是O;
(2)①根据图象知,反应物是NO、NO2和NH3,生成物是N2和H2O,氮氧化物中N元素化合价由正化合价变为0价、氨气中N元素化合价由-3价变为0价,所以氧化剂是NO、NO2;
②根据纵坐标判断,相同温度下,脱氢率越高的效果越好,所以其比值为1:1时最好;
(3)根据N原子守恒得n(NaNO3)=n(NOx)-n(NaNO2)=0.5mol-0.35mol=0.15mol,NO、NO2和NaOH溶液反应方程式为2NO2+2NaOH=NaNO2+NaNO3+H2O和NO+NO2+2NaOH=2NaNO2+H2O,生成0.15mol硝酸钠需要0.3molNO2,同时生成0.15mol亚硝酸钠,含有0.2mol的亚硝酸钠是NO和NO2混合与NaOH反应得到的,得到的0.2mol亚硝酸钠需要0.1molNO2、0.1molNO,所以NO、NO2的物质的量分别是0.1mol、0.4mol,则尾气中NO与NO2的物质的量之比为1:4;
(4)100~200mL时,溶解金属质量=18.0g-9.6g=8.4g,金属有剩余,说明生成的金属阳离子是二价铁离子,增加n(NO)=(4.48L2.24L)÷22.4L/mol=0.1mol,根据转移电子守恒得n(金属)=0.1mol×(52)/2=0.15mol,金属平均摩尔质量=8.4g/0.15mol=56g/mol,所以溶解的是Fe;且0~100mL溶解的铁和100~200mL溶解的铁质量相等,因此0~100mL溶解的Fe为8.4g;200~300mL时,溶解金属质量=9.6g-0=9.6g,增加n(NO)=(6.72L4.48L)÷22.4L/mol=0.1mol,假设溶解的完全是铜,根据转移电子守恒得n(金属)=0.1mol×(52)/2=0.15mol,金属平均摩尔质量=9.6g/0.15mol=64g/mol,所以溶解的完全是Cu,即铁恰好和200mL硝酸完全反应生成硝酸亚铁;则n(Fe)=(8.4g+8.4g)÷56g/mol=0.3mol,因此n(Fe):n(Cu)=0.3mol:0.15mol=2:1。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】对于反应3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)的平衡常数,下列说法正确的是
Fe3O4(s)+4H2(g)的平衡常数,下列说法正确的是
A.增大H2O(g)的浓度或减小H2的浓度,会使平衡常数减小
B.改变反应的温度,平衡常数不一定变化
C.K=![]()
D.K=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活、社会密切相关,下列说法正确的是
A.利用海水制取氯化钠、烧碱、纯碱、氯气等物质都发生了氧化还原反应
B.蛋白质、葡萄糖、纤维素、油脂等都能在人体内水解并提供能量
C.为了提高生活用水的卫生标准,自来水厂常使用![]() 和
和![]() 进行消毒、净化、以改善水质
进行消毒、净化、以改善水质
D.塑料、合成橡胶和纤维这三大合成材料,都主要以石油、煤和天然气为原料生产的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A.25℃ 101kPa时,CH4(g)+2O2(g)=CO2(g) +2H2O(g) △H=-Q kJ/mol,则甲烷的燃烧热为Q kJ/mol
B.CaCO3(s)=CaO(s)+CO2(g) 室温下不能自发进行,说明该反应的 ΔH<0
C.反应N2(g)+3H2(g)![]() 2NH3(g)ΔH<0达到平衡后,升高温度,反应速率v(H2)和H2的平衡转化率均增大
2NH3(g)ΔH<0达到平衡后,升高温度,反应速率v(H2)和H2的平衡转化率均增大
D.已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2的值均大于零):H2(g) +Cl2(g)=2HCl(g),△H1=—Q1 kJ/mol,H2(g) +Br2(g)=2HBr(g),△H2=—Q2 kJ/mol,则△H1<△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下能实现的是
① FeS2![]() SO2
SO2![]() H2SO4
H2SO4
② SiO2![]() SiCl4
SiCl4![]() Si
Si
③ 饱和NaCl溶液![]() NaHCO3
NaHCO3 ![]() Na2CO3
Na2CO3
④ 1 mol·L-1HCl(aq)![]() Cl2
Cl2![]() Ca(ClO)2
Ca(ClO)2
⑤ CuSO4(aq) ![]() Cu(OH)2
Cu(OH)2 ![]() Cu2O
Cu2O
A. ①③⑤ B. ②③④ C. ②④⑤ D. ①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积固定的2L的密闭容器中,一定量的SO2与1mol O2在催化剂作用下加热到600℃发生反应:2SO2+O2![]() 2SO3;△H<0。当气体的物质的量减少0.2mol时反应达到平衡,在相同的温度下测得气体压强为反应前的8/9。下列有关叙述正确的是( )
2SO3;△H<0。当气体的物质的量减少0.2mol时反应达到平衡,在相同的温度下测得气体压强为反应前的8/9。下列有关叙述正确的是( )
A. 当SO3的生成速率与SO2的消耗速率相等时反应达到平衡
B. 降低温度,正反应速率减小程度比逆反应速率减小程度大
C. 将生成物SO3通入过量BaCl2溶液中,得到沉淀的质量为233g
D. 达到平衡时,平衡常数为2.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,10mL0.40mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)![]()
![]() mol/(L·min)
mol/(L·min)
B.6~10min的平均反应速率:v(H2O2)<![]() mol/(L·min)
mol/(L·min)
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属于取代反应的是
①CH3CH=CH2+Br2![]() CH3CHBrCH2Br
CH3CHBrCH2Br
②CH3CH2OH![]() CH2=CH2+H2O
CH2=CH2+H2O
③CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
④C6H6+HNO3![]() C6H5NO2+H2O
C6H5NO2+H2O
A. ①②B. ③④C. ①③D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:______________。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是________________________
(3)吸收液吸收SO2的过程中,pH随n(SO3﹣):n(HSO3﹣)变化关系如下表:
n(SO﹣):n(HSO﹣) | 91:9 | 1:1 | 1:91 |
pH | 8.2 | 7.2 | 6.2 |
①上表判断NaHSO3溶液显______性,用化学平衡原理解释:____________
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):____________
a.c(Na+)=2c(SO32-)+c(HSO3-),
b.c(Na+)> c(HSO3-)> c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)= c(SO32-)+ c(HSO3-)+c(OH-)
(4)当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如下:
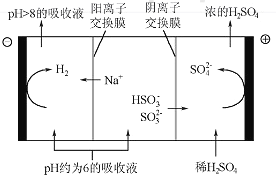
①HSO3-在阳极放电的电极反应式是_______________。
②当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理:__________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com