
【题目】某小组为探究![]() 溶液和不同类型盐溶液反应的多样性,设计如图实验:
溶液和不同类型盐溶液反应的多样性,设计如图实验:

已知:AgSCN为白色难溶物。
下列说法不正确的是( )
A.①中的白色沉淀是![]()
B.向①的试管中滴加![]() KI溶液,有黄色沉淀生成证明存在
KI溶液,有黄色沉淀生成证明存在![]()
C.②中发生了氧化还原反应
D.对于③中红色褪去的原因可能与平衡移动原理有关
【答案】B
【解析】
解此题时,要注意实验中试剂的用量,我们看到滴加入试管中的都只有几滴试剂,所以试管![]() 中含反应后过量的Ag+、
中含反应后过量的Ag+、![]() 、
、![]() ;结合试管③中的现象,试管②上层清液含Ag+、Fe3+、
;结合试管③中的现象,试管②上层清液含Ag+、Fe3+、![]() 、
、![]() ,再按加入的物质判断选项是否正确。
,再按加入的物质判断选项是否正确。
A.硝酸银溶液中滴入硫酸铵,生成白色沉淀为硫酸银,化学式为![]() ,A正确;
,A正确;
B.试管![]() 中含过量的Ag+、
中含过量的Ag+、![]() 、
、![]() ,滴加
,滴加![]() KI溶液,与Ag+直接反应生成黄色沉淀AgI,并不能证明发生了沉淀的转化,B错误;
KI溶液,与Ag+直接反应生成黄色沉淀AgI,并不能证明发生了沉淀的转化,B错误;
C.![]() 中硝酸银溶液中滴入硫酸亚铁铵溶液,有白色沉淀生成,试管壁有银析出,可能是银离子氧化亚铁离子为铁离子,银离子被还原为银单质,
中硝酸银溶液中滴入硫酸亚铁铵溶液,有白色沉淀生成,试管壁有银析出,可能是银离子氧化亚铁离子为铁离子,银离子被还原为银单质,![]() 发生了氧化还原反应,C正确;
发生了氧化还原反应,C正确;
D.试管②上层清液含Ag+、Fe3+、![]() 、
、![]() ,滴加几滴KSCN溶液,产生白色沉淀为AgSCN,溶液局部变红色,那么局部溶液发生反应
,滴加几滴KSCN溶液,产生白色沉淀为AgSCN,溶液局部变红色,那么局部溶液发生反应![]() ,振荡后红色褪去,沉淀量增加,有可能是溶液中过量银离子与硫氰根反应生成AgSCN白色沉淀,降低了硫氰根离子的浓度,
,振荡后红色褪去,沉淀量增加,有可能是溶液中过量银离子与硫氰根反应生成AgSCN白色沉淀,降低了硫氰根离子的浓度,![]() 平衡一直逆向进行,溶液红色会变淡直到消失, D正确;
平衡一直逆向进行,溶液红色会变淡直到消失, D正确;
答案选B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某研究性学习小组制备高铁酸钾(K2FeO4)并探究其性质。查阅文献,得到以下资料: K2FeO4为紫色固体,微溶于 KOH 溶液;具有强氧化性,在酸性或中性溶液中快速产生 O2,在碱性溶液中较稳定。
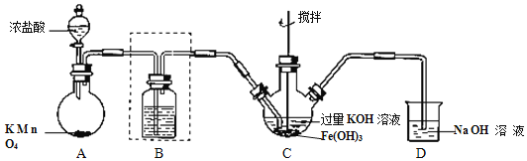
Ⅰ.制备 K2FeO4(夹持装置略)。
(1)A 为氯气的实验室发生装置。A 中反应方程式是______(锰被还原为 Mn2+)。若反应中有 0.5molCl2产生,则电子转移的数目为______。工业制氯气的反应方程式为______。
(2)装置 B 中盛放的试剂是______,简述该装置在制备高铁酸钾中的作用______。
(3)C 中得到紫色固体和溶液。C 中 Cl2发生的反应有:3Cl2+2Fe(OH)3+10KOH→2K2FeO4+6KCl+8H2O,根据该反应方程式得出:碱性条件下,氧化性 Cl2______FeO42-(填“>”或“<”)。另外C中还可能发生其他反应,请用离子方程式表示______。
Ⅱ.探究 K2FeO4 的性质
(4)甲同学取少量 K2FeO4 加入浑浊的泥浆水中,发现产生气体,搅拌,浑浊的泥浆水很快澄清。请简述 K2FeO4的净水原理。______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)的平衡常数,下列说法正确的是
Fe3O4(s)+4H2(g)的平衡常数,下列说法正确的是
A.增大H2O(g)的浓度或减小H2的浓度,会使平衡常数减小
B.改变反应的温度,平衡常数不一定变化
C.K=![]()
D.K=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸性废液中含有Fe2+、Cu2+、Ba2+三种金属离子,有同学设计了下列方案对废液进行处理(所加试剂均稍过量),以回收金属铜,保护环境。下列叙述错误的是( )
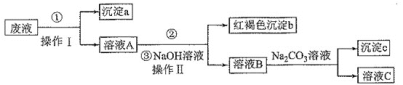
A.沉淀a中含有的单质是Cu、Fe
B.②的离子方程式是Fe2++H2O2+H+=Fe3++2H2O
C.操作Ⅱ用到的主要玻璃仪器有烧杯、漏斗、玻璃棒
D.溶液B中含有的阳离子主要是Ba2+、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 0.2 mol·L-1与0.1 mol·L-1 HClO溶液中c(H+)之比为2:1
B. pH=2和pH=1的硝酸中c(H+)之比为1:2
C. 25 ℃时,0.1 mol·L-1CH3COOH的电离平衡常数K=2×10-5,则0.1 mol·L-1CH3COONa的水解平衡常数为5×10-10
D. 0.1 mol·L-1NaHCO3溶液中:c (Na+)+ c (H+)+ c (H2CO3)<c (HCO3-) +3 c (CO32-) + c (OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液,一定呈中性的是
A. 由等体积、等物质的量浓度的硫酸跟NaOH溶液混合后所形成的溶液
B. c(H+)=1.0×10-7mol·L-1的溶液
C. pH=7的溶液
D. c(H+)=![]() 的溶液(Kw为该温度下水的离子积常数)
的溶液(Kw为该温度下水的离子积常数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活、社会密切相关,下列说法正确的是
A.利用海水制取氯化钠、烧碱、纯碱、氯气等物质都发生了氧化还原反应
B.蛋白质、葡萄糖、纤维素、油脂等都能在人体内水解并提供能量
C.为了提高生活用水的卫生标准,自来水厂常使用![]() 和
和![]() 进行消毒、净化、以改善水质
进行消毒、净化、以改善水质
D.塑料、合成橡胶和纤维这三大合成材料,都主要以石油、煤和天然气为原料生产的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A.25℃ 101kPa时,CH4(g)+2O2(g)=CO2(g) +2H2O(g) △H=-Q kJ/mol,则甲烷的燃烧热为Q kJ/mol
B.CaCO3(s)=CaO(s)+CO2(g) 室温下不能自发进行,说明该反应的 ΔH<0
C.反应N2(g)+3H2(g)![]() 2NH3(g)ΔH<0达到平衡后,升高温度,反应速率v(H2)和H2的平衡转化率均增大
2NH3(g)ΔH<0达到平衡后,升高温度,反应速率v(H2)和H2的平衡转化率均增大
D.已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2的值均大于零):H2(g) +Cl2(g)=2HCl(g),△H1=—Q1 kJ/mol,H2(g) +Br2(g)=2HBr(g),△H2=—Q2 kJ/mol,则△H1<△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属于取代反应的是
①CH3CH=CH2+Br2![]() CH3CHBrCH2Br
CH3CHBrCH2Br
②CH3CH2OH![]() CH2=CH2+H2O
CH2=CH2+H2O
③CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
④C6H6+HNO3![]() C6H5NO2+H2O
C6H5NO2+H2O
A. ①②B. ③④C. ①③D. ②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com