
【题目】下列离子方程式正确的是
A.NaClO溶液与FeCl2溶液混合:Fe2++2ClO-+2H2O===Fe(OH)2↓ + 2HClO
B.苯酚钠溶液中通入少量CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3-
C.澄清石灰水与过量NaHCO3溶液反应:HCO3-+Ca2++OH-===CaCO3↓+H2O
D.铵明矾[NH4Al(SO4)2·12H2O]溶液中加入过量Ba(OH)2溶液: Al3++2(SO4)2-+2Ba2++4OH-===AlO2-+2BaSO4↓+2H2O
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是()
A.![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
B.由水电离的c(H+)=1×10-14mol/L的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
C.![]()
![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
D.![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,现有氨水和盐酸两溶液。回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中 ________。(增大、减小、不变)
________。(增大、减小、不变)
(2)若向该氨水中加入氢氧化钠固体,则该电离平衡向_________方向移动(分子化、离子化),电离平衡常数______________。(增大、减小或不变)
(3)0.2 mol/L氨水和0.2 mol/L 盐酸溶液与等体积混合,溶液呈_____性 (酸、碱、中) ;其原因用离子方程式表示为__________________。混合液中,c(NH4+)+c(NH3H2O)=_______mol/L。(忽略体积变化)。请根据电荷守恒写出一个用离子浓度表示的等式_____________________。
(4)用0.1000mol/L HCl溶液滴定未知浓度的NaOH溶液,重复三次的实验数据如下所示
序号 | 0.100mol/L HCl溶液体积/mL | 待测NaOH溶液体积/mL |
1 | 27.83 | 25.00 |
2 | 26.53 | 25.00 |
3 | 27.85 | 25.00 |
该滴定可以使用的指示剂是__________;达到滴定终点时的现象是____________________。
待测NaOH溶液的物质的量浓度为_____________mol/L。(保留四位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器内,使1molN2和3molH2混合发生下列反应:3H2+N2![]() 2NH3△H<0。
2NH3△H<0。
(1)合成氨时选择500℃高温的目的是______________。
(2)当反应达到平衡时,N2和H2的浓度比是_______。
(3)当达到平衡吋,充入氩气,并保持体积不变,平衡将______移动。
(4)当达到平衡时,充入氩气,并保持压强不变,平衡将______移动,反应速率将_______。
(5)当达到平衡时,充入N2并保持体积不变,平衡将______移动。
(6)当达到平衡时,保持体积不变,升高温度时,混合气体的平均相对分子质量_______(选填“增大”“减小”或“不变”,后同),密度________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)的平衡常数,下列说法正确的是
Fe3O4(s)+4H2(g)的平衡常数,下列说法正确的是
A.增大H2O(g)的浓度或减小H2的浓度,会使平衡常数减小
B.改变反应的温度,平衡常数不一定变化
C.K=![]()
D.K=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫、氯的单质和化合物应用广泛。
(1)将硫铁矿和焦炭按物质的量之比为3∶2混合放在炼硫炉中,通入适量空气,发生下列燃烧反应:
FeS2+C+O2→Fe3O4+CO+S。
配平上述化学反应方程式:______________________________。生成3 mol硫,被氧化物质的物质的量为__________________。
(2)盐酸是应用广泛的酸之一,它具有
a.酸性;b.氧化性;c.还原性;d.挥发性。
请回答下列问题:
①浓盐酸长时间露置在空气中,溶液的质量减轻,盐酸表现了________(填序号)。
②实验室用稀盐酸和锌粒反应制取氢气,盐酸表现了________(填序号),反应的离子方程式为_____________________________________________________________________。
③用盐酸除去铁表面的铁锈,盐酸表现了______(填序号),反应的离子方程式为__________________________________________________________________。
④实验室常用KMnO4和浓盐酸反应制取Cl2,反应的化学方程式为2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。被还原的元素是______,还原剂是______,氧化产物是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸性废液中含有Fe2+、Cu2+、Ba2+三种金属离子,有同学设计了下列方案对废液进行处理(所加试剂均稍过量),以回收金属铜,保护环境。下列叙述错误的是( )
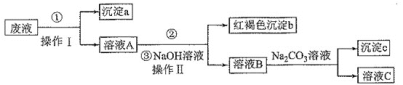
A.沉淀a中含有的单质是Cu、Fe
B.②的离子方程式是Fe2++H2O2+H+=Fe3++2H2O
C.操作Ⅱ用到的主要玻璃仪器有烧杯、漏斗、玻璃棒
D.溶液B中含有的阳离子主要是Ba2+、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液,一定呈中性的是
A. 由等体积、等物质的量浓度的硫酸跟NaOH溶液混合后所形成的溶液
B. c(H+)=1.0×10-7mol·L-1的溶液
C. pH=7的溶液
D. c(H+)=![]() 的溶液(Kw为该温度下水的离子积常数)
的溶液(Kw为该温度下水的离子积常数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积固定的2L的密闭容器中,一定量的SO2与1mol O2在催化剂作用下加热到600℃发生反应:2SO2+O2![]() 2SO3;△H<0。当气体的物质的量减少0.2mol时反应达到平衡,在相同的温度下测得气体压强为反应前的8/9。下列有关叙述正确的是( )
2SO3;△H<0。当气体的物质的量减少0.2mol时反应达到平衡,在相同的温度下测得气体压强为反应前的8/9。下列有关叙述正确的是( )
A. 当SO3的生成速率与SO2的消耗速率相等时反应达到平衡
B. 降低温度,正反应速率减小程度比逆反应速率减小程度大
C. 将生成物SO3通入过量BaCl2溶液中,得到沉淀的质量为233g
D. 达到平衡时,平衡常数为2.5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com