
����Ŀ�����ܱ������ڣ�ʹ1molN2��3molH2��Ϸ������з�Ӧ��3H2+N2![]() 2NH3��H��0��
2NH3��H��0��
��1���ϳɰ�ʱѡ��500����µ�Ŀ����______________��
��2������Ӧ�ﵽƽ��ʱ��N2��H2��Ũ�ȱ���_______��
��3�����ﵽƽ�ⅼ�����������������������䣬ƽ�⽫______�ƶ���
��4�����ﵽƽ��ʱ�����������������ѹǿ���䣬ƽ�⽫______�ƶ�����Ӧ���ʽ�_______��
��5�����ﵽƽ��ʱ������N2������������䣬ƽ�⽫______�ƶ���
��6�����ﵽƽ��ʱ������������䣬�����¶�ʱ����������ƽ����Է�������_______��ѡ��������������С����������������ͬ�����ܶ�________��
���𰸡��ӿ췴Ӧ���ʣ��Ҵ����Ļ������ 1:3 �� ���� ��С ���� ��С ����
��������
��1��500������ʱ�������Ļ����������ѡ�����500�����ҵ��¶Ƚ��У�
��2��������ʼ�������������仯��֮�ȵ��ڻ�ѧ������֮�ȷ����жϣ�
��3�����ﵽƽ�ⅼ�����������������������䣬��������ѹ���������ʵķ�ѹ���䣻
��4�����ﵽƽ��ʱ�����������������ѹǿ���䣬�����������൱�ڼ�Сѹǿ��
��5�����ﵽƽ�ⅼ������N2������������䣬����Ӧ�ﵪ����Ũ�ȣ�
��6������������䣬�����¶�ʱ��ƽ�����淴Ӧ�����ƶ������������������䣬������������ʵ������
��1���ϳɰ���Ӧ�����������С�ķ��ȷ�Ӧ��Ҫʹƽ��������Ӧ�����ƶ���Ӧ�����¶ȡ�����ѹǿ�����¶ȹ��ͷ�Ӧ���ʹ�С�������ڹ�ҵ����Ч�棻�¶�Խ�ߣ���Ӧ����Խ������Ӧ�ʵ������¶ȣ�ʹ��Ӧ��������ʹ�ô���Ҳ������Ӧ���ʣ�����500������ʱ�����Ļ����������ѡ�����500�����ҵ��¶Ƚ��У��ʴ�Ϊ���ӿ췴Ӧ���ʣ��Ҵ����Ļ������
��2�����ܱ������У�ʹ2molN2��6molH2��Ϸ������з�Ӧ��N2��g��+3H2��g��2NH3��g������Ӧ����ʼ��֮�ȵ��ڻ�ѧ����ʽ�еĻ�ѧ������֮�ȣ��ɷ�Ӧ�仯��֮�ȵ��ڵ��ڻ�ѧ������֮�ȿ�֪��Ӧ��ƽ��Ũ��Ϊ1��3���ʴ�Ϊ��1��3��
��3�����ﵽƽ�ⅼ�����������������������䣬��������ѹ���������ʵķ�ѹ���䣬Ũ�Ȳ��䣬ƽ�ⲻ�����ʴ�Ϊ������
��4�����ﵽƽ��ʱ�����������������ѹǿ���䣬�����������൱�ڼ�Сѹǿ���ϳɰ���Ӧ�����������С�ķ��ȷ�Ӧ����Сѹǿ����ѧ��Ӧ���ʼ�С��ƽ�����淴Ӧ�����ƶ����ʴ�Ϊ����С������
��5�����ﵽƽ�ⅼ������N2������������䣬����Ӧ�ﵪ����Ũ�ȣ�ƽ��������Ӧ�����ƶ����ʴ�Ϊ������
��6������������䣬�����¶�ʱ��ƽ�����淴Ӧ�����ƶ������������������䣬������������ʵ��������M=![]() ��֪��ƽ����Է�������M��С����d=
��֪��ƽ����Է�������M��С����d=![]() ��֪�ܶ�d���䣬�ʴ�Ϊ����С�����䡣
��֪�ܶ�d���䣬�ʴ�Ϊ����С�����䡣


 ��������ܸ�ϰϵ�д�
��������ܸ�ϰϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����VmL0.1mol/L��ˮ�еμӵ����ʵ���Ũ�ȵ�ϡH2SO4����û����Һ���¶Ⱥ�pOH[pOH����lgc(OH��)]���ż���ϡ���������ı仯��ͼ��ʾ(ʵ��Ϊ�¶ȱ仯������ΪpOH�仯)������˵������ȷ���ǣ� ��
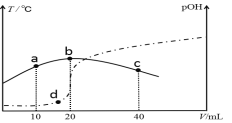
A. a��b��c������ˮ�����c(H+)���μ�С
B. V��40
C. b��ʱ��Һ��pOH>pH
D. a��b��d�����ӦNH3��H2O�ĵ��볣����K(b)>K(d)>K(a)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�̶��ݻ����ܱ������У����淴Ӧ�� H2(g) + I2(g) ![]() 2HI (g)�ﵽƽ��ı�־��
2HI (g)�ﵽƽ��ı�־��
A. H2��I2��HI�ķ�����֮��Ϊ1��1��2
B. ���������ܶȱ��ֲ���
C. ��λʱ������n mol H2��ͬʱ����2n mol HI
D. ����������ɫ���ٷ����仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�����ˮ���˵����,����ȷ����( )��
A. �����ˮ������ƻ��˴�ˮ�ĵ���ƽ��
B. �����ˮ��������кͷ�Ӧ���淴Ӧ
C. ����ˮ������Һ��һ��������
D. ![]() ��Һ��,
��Һ��, ![]() ��
��![]() ������
������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں��º��������з���N2O4��g��2NO2��g��������Ӧ���Ũ����0.1molL��1����0.06molL��1��20s����ô��0.06molL��1����0.036molL��1�����跴Ӧʱ��Ϊ��������
A. 10 sB. 12 sC. ����12 sD. ��12 s
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�����ͨѶ����ͨ���ճ����������Ź㷺��Ӧ�ã�Ŀǰ���õ�����Ni���ӣ�Cd����أ������ܷ�Ӧ���Ա�ʾΪ��Cd+2NiO(OH)+2H2O![]() 2Ni(OH)2+Cd(OH)2,��֪Ni(OH)2��Cd(OH)2��������ˮ���������ᣬ����˵����ȷ����
2Ni(OH)2+Cd(OH)2,��֪Ni(OH)2��Cd(OH)2��������ˮ���������ᣬ����˵����ȷ����
�����Ϸ�Ӧ�ǿ��淴Ӧ �����Ϸ�Ӧ���ǿ��淴Ӧ
��CdΪ��ص����� �ܷŵ�ʱ��ѧ��ת��Ϊ���ܣ�
A.�٢�B.�ڢ�C.�٢�D.�ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ȷ����
A.NaClO��Һ��FeCl2��Һ��ϣ�Fe2����2ClO����2H2O===Fe(OH)2�� �� 2HClO
B.��������Һ��ͨ������CO2��C6H5O����CO2��H2O��C6H5OH��HCO3��
C.����ʯ��ˮ�����NaHCO3��Һ��Ӧ��HCO3����Ca2����OH��===CaCO3����H2O
D.�����[NH4Al(SO4)2��12H2O]��Һ�м������Ba(OH)2��Һ�� Al3����2(SO4)2����2Ba2����4OH��===AlO2����2BaSO4����2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ��������������ԭ�����͵���
A����ˮ��������ƽ��Br2+H2O![]() HBr+HBrO,��������������Һ��,��Һ��ɫ��dz
HBr+HBrO,��������������Һ��,��Һ��ɫ��dz
B���Ӵ���,ʹN2��H2��һ��������ת��ΪNH3
C����ӦCO(g)+NO2(g)CO2(g)+NO(g) ��H<0,��ƽ���,�����¶���ϵ��ɫ����
D������ѹǿ,������SO2��O2��Ӧ����SO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ����ᡢ����������������أ�����˵����ȷ���ǣ� ��
A.![]() �����ڼ���ƾ����Ƿ���ˮ
�����ڼ���ƾ����Ƿ���ˮ
B.![]() ��ָ������ֱ��С�ڻ����
��ָ������ֱ��С�ڻ����![]() �Ŀ������ΰ��������ȼ����ķ���������أ������������������Ҫԭ��
�Ŀ������ΰ��������ȼ����ķ���������أ������������������Ҫԭ��
C.����ˮ����������ˮ����![]() ��
��![]() ���ܴ���������ˮ
���ܴ���������ˮ
D.����ֲ����и��������������˴Ӻ���Ʒ����ȡ���ǹ�ҵ�ϻ�ȡ�����Ҫ;������ҵ�ϴӺ�������ȡ��IJ����У�����![]() ����
����![]() ����
����![]() ��ȡ
��ȡ![]() �ֵ��ᴿ
�ֵ��ᴿ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com