
【题目】化学与社会、生产、生活密切相关,下列说法正确的是( )
A.![]() 可用于检验酒精中是否含有水
可用于检验酒精中是否含有水
B.![]() 是指大气中直径小于或等于
是指大气中直径小于或等于![]() 微米的颗粒物,与肺癌、哮喘等疾病的发生密切相关,是造成雾霾天气的主要原因
微米的颗粒物,与肺癌、哮喘等疾病的发生密切相关,是造成雾霾天气的主要原因
C.自来水厂用明矾净水,用![]() 或
或![]() 均能代替明矾净水
均能代替明矾净水
D.海洋植物具有富集碘的能力,因此从海产品中提取碘是工业上获取碘的重要途径,工业上从海带中提取碘的步骤有:灼烧![]() 浸泡
浸泡![]() 过滤
过滤![]() 萃取
萃取![]() 粗碘提纯
粗碘提纯
【答案】B
【解析】
A.无水硫酸铜遇水变蓝;
B.固体颗粒物可导致雾霾发生;
C.![]() 具有强氧化性,明矾水解生成胶体可净化水;
具有强氧化性,明矾水解生成胶体可净化水;
D.海带灼烧、溶解过滤后,碘以离子存在,不能用萃取剂萃取。
![]() 无水硫酸铜遇水变蓝,可检验酒精中是否含有水,而
无水硫酸铜遇水变蓝,可检验酒精中是否含有水,而![]() 不能,故A错误;
不能,故A错误;
B.固体颗粒物可导致雾霾发生,则![]() 是指大气中直径小于或等于
是指大气中直径小于或等于![]() 微米的颗粒物,与肺癌、哮喘等疾病的发生密切相关,是造成雾霾天气的主要原因,故B正确;
微米的颗粒物,与肺癌、哮喘等疾病的发生密切相关,是造成雾霾天气的主要原因,故B正确;
C. 明矾水解生成胶体可净化水,而![]() 具有强氧化性,能杀菌消毒,但是不能净水,不能用
具有强氧化性,能杀菌消毒,但是不能净水,不能用![]() 代替明矾净水,故C错误;
代替明矾净水,故C错误;
D.海带灼烧、溶解、过滤后,碘以离子存在,还需要加氧化剂氧化碘离子,然后萃取、蒸馏分离出碘,故D错误;
故选:B。


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
【题目】在密闭容器内,使1molN2和3molH2混合发生下列反应:3H2+N2![]() 2NH3△H<0。
2NH3△H<0。
(1)合成氨时选择500℃高温的目的是______________。
(2)当反应达到平衡时,N2和H2的浓度比是_______。
(3)当达到平衡吋,充入氩气,并保持体积不变,平衡将______移动。
(4)当达到平衡时,充入氩气,并保持压强不变,平衡将______移动,反应速率将_______。
(5)当达到平衡时,充入N2并保持体积不变,平衡将______移动。
(6)当达到平衡时,保持体积不变,升高温度时,混合气体的平均相对分子质量_______(选填“增大”“减小”或“不变”,后同),密度________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液,一定呈中性的是
A. 由等体积、等物质的量浓度的硫酸跟NaOH溶液混合后所形成的溶液
B. c(H+)=1.0×10-7mol·L-1的溶液
C. pH=7的溶液
D. c(H+)=![]() 的溶液(Kw为该温度下水的离子积常数)
的溶液(Kw为该温度下水的离子积常数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)硅和氯两元素的单质反应生成1 mol Si的最高价化合物,恢复至室温,放热687 kJ,已知该化合物的熔、沸点分别为-69 ℃和58 ℃,写出该反应的热化学方程式___________________________________。
(2)肼(N2H4)可作为火箭发动机的燃料,与氧化剂 N2O4反应生成 N2 和水蒸气。
已知:①N2(g)+2O2(g)=N2O4(l) ΔH1=-19.5 kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2=-534.2 kJ·mol-1
写出肼和 N2O4反应的热化学方程式___________________。
(3)饮用水中的 NO3-主要来自 NH4+。已知在微生物的作用下,NH 4+经过两步反应被氧化成 NO3-。两步反应的能量变化示意图如图:
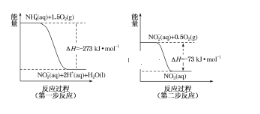
1mol NH 4+全部被氧化成 NO3-的热化学方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A.25℃ 101kPa时,CH4(g)+2O2(g)=CO2(g) +2H2O(g) △H=-Q kJ/mol,则甲烷的燃烧热为Q kJ/mol
B.CaCO3(s)=CaO(s)+CO2(g) 室温下不能自发进行,说明该反应的 ΔH<0
C.反应N2(g)+3H2(g)![]() 2NH3(g)ΔH<0达到平衡后,升高温度,反应速率v(H2)和H2的平衡转化率均增大
2NH3(g)ΔH<0达到平衡后,升高温度,反应速率v(H2)和H2的平衡转化率均增大
D.已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2的值均大于零):H2(g) +Cl2(g)=2HCl(g),△H1=—Q1 kJ/mol,H2(g) +Br2(g)=2HBr(g),△H2=—Q2 kJ/mol,则△H1<△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语的相关表述中正确的是
A. 因H+(aq) +OH- (aq)==H2O(l) △H=-akJ·mol-1,故1molNaOH固体与足量的稀盐酸反应,放出的热量为akJ
B. 因CuSO4·5H2O(s)==CuSO4(s)+5H2O(1)△H=+bkJ·mol-1,故1molCuSO4(s)溶于水时,放出的热量为bkJ
C. 因氢气的燃烧热为c kJ·mol-1,故水电解的热化学方程式为2H2O (l)==2H2(g)+O2(g) △H=+c kJ·mol-1
D. 因N2(g)+3H2(g)![]() 2NH3(g) △H=-d kJ·mol-1,故在某容器中通入1molN2与3molH2充分反应后,放出的热量小于dkJ
2NH3(g) △H=-d kJ·mol-1,故在某容器中通入1molN2与3molH2充分反应后,放出的热量小于dkJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积固定的2L的密闭容器中,一定量的SO2与1mol O2在催化剂作用下加热到600℃发生反应:2SO2+O2![]() 2SO3;△H<0。当气体的物质的量减少0.2mol时反应达到平衡,在相同的温度下测得气体压强为反应前的8/9。下列有关叙述正确的是( )
2SO3;△H<0。当气体的物质的量减少0.2mol时反应达到平衡,在相同的温度下测得气体压强为反应前的8/9。下列有关叙述正确的是( )
A. 当SO3的生成速率与SO2的消耗速率相等时反应达到平衡
B. 降低温度,正反应速率减小程度比逆反应速率减小程度大
C. 将生成物SO3通入过量BaCl2溶液中,得到沉淀的质量为233g
D. 达到平衡时,平衡常数为2.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】平板电视显示屏生产过程中会产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2)。利用废玻璃粉末可以制取多种化工产品。设计流程如下:

查阅资料可知:
①CeO2性质:淡黄或黄褐色粉末,不溶于水和碱,微溶于酸;有强氧化性。
②Ce3+在碱金属碳酸盐溶液中生成难溶的碳酸复盐Ce2(CO3):Na2CO3·2H2O。
③常温时两种沉淀物的溶度积见表:
沉淀物 | Fe(OH)3 | Ce(OH)3 |
Ksp | 4.0×10-38 | 1.5×10-20 |
回答下列问题:
(1)过程①分离操作中用到的玻璃仪器有_______________________________。
(2)过程④中发生反应的离子方程式为_________________________________,过程⑥中发生的化学反应方程式为__________________________________。
(3)产品I是一种新型、绿色的多功能净水剂,集氧化、灭菌、消毒、吸附、絮凝、沉淀等性能为一体。净水过程中,Na2FeO4 起到吸附、絮凝作用的原理是_________________。
(4)工业上也可用电解浓NaOH溶液制备产品I。用铁做电极,写出电解时阳极发生的电极反应方程式_________________。
(5)沉淀过程中,当某种离子浓度降至10—5 mol·L-1时,可认为此离子完全沉淀。过程②中Fe3+沉淀完全时溶液的pH=_____ (已知 lg2=0.3)。
(6)写出产品III的一种用途______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铁铵[NH4Fe(SO4)2·xH2O]是一种重要铁盐。为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁铵,具体流程如下:

回答下列问题:
(1)步骤①的目的是去除废铁屑表面的油污,方法是_________________。
(2)步骤②需要加热的目的是_________________,温度保持80~95 ℃,采用的合适加热方式是_________________。铁屑中含有少量硫化物,反应产生的气体需要净化处理,合适的装置为_________________(填标号)。

(3)步骤③中选用足量的H2O2,理由是_________________。分批加入H2O2,同时为了_________________,溶液要保持pH小于0.5。
(4)步骤⑤的具体实验操作有______________,经干燥得到硫酸铁铵晶体样品。
(5)采用热重分析法测定硫酸铁铵晶体样品所含结晶水数,将样品加热到150 ℃时,失掉1.5个结晶水,失重5.6%。硫酸铁铵晶体的化学式为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com