
【题目】(1)硅和氯两元素的单质反应生成1 mol Si的最高价化合物,恢复至室温,放热687 kJ,已知该化合物的熔、沸点分别为-69 ℃和58 ℃,写出该反应的热化学方程式___________________________________。
(2)肼(N2H4)可作为火箭发动机的燃料,与氧化剂 N2O4反应生成 N2 和水蒸气。
已知:①N2(g)+2O2(g)=N2O4(l) ΔH1=-19.5 kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2=-534.2 kJ·mol-1
写出肼和 N2O4反应的热化学方程式___________________。
(3)饮用水中的 NO3-主要来自 NH4+。已知在微生物的作用下,NH 4+经过两步反应被氧化成 NO3-。两步反应的能量变化示意图如图:
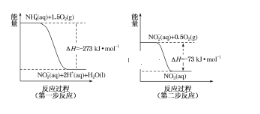
1mol NH 4+全部被氧化成 NO3-的热化学方程式为_______________________。
【答案】Si(s)+2Cl2(g)=SiCl4(l) ΔH=-687 kJ/mol 2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH=-1048.9 kJ·mol-1 NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(l) ΔH=-346 kJ·mol-1
【解析】
(1) 1 mol Si的最高价氯化物为SiCl4,该化合物的熔、沸点分别为-69 ℃和58 ℃,则常温下呈液态,该反应的热化学方程式为Si(s)+2Cl2(g)=SiCl4(l) ΔH=-687 kJ/mol。
(2)①N2(g)+2O2(g)=N2O4(l) ΔH1=-19.5 kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2=-534.2 kJ·mol-1
②×2-①即得肼和 N2O4反应的热化学方程式。
(3)从图中可以看出,两步反应都为放热反应,1mol NH 4+全部被氧化成 NO3-的热焓变,为图中两步反应的热焓变之和。
(1) 1 mol Si的最高价氯化物为SiCl4,该化合物的熔、沸点分别为-69 ℃和58 ℃,则常温下呈液态,该反应的热化学方程式为Si(s)+2Cl2(g)=SiCl4(l) ΔH=-687 kJ/mol。
答案为:Si(s)+2Cl2(g)=SiCl4(l) ΔH=-687 kJ/mol;
(2)①N2(g)+2O2(g)=N2O4(l) ΔH1=-19.5 kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2=-534.2 kJ·mol-1
②×2-①即得肼和N2O4反应的热化学方程式为2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH=-1048.9 kJ·mol-1,
答案为:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH=-1048.9 kJ·mol-1;
(3)从图中可以看出,两步反应都为放热反应,1mol NH4+全部被氧化成NO3-的热焓变,为图中两步反应的热焓变之和。从而得出1mol NH4+全部被氧化成 NO3-的热化学方程式为NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(l) ΔH=-346 kJ·mol-1,
答案为:NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(l) ΔH=-346 kJ·mol-1。


科目:高中化学 来源: 题型:
【题目】下列有关盐类水解的说法中,不正确的是( )。
A. 盐类的水解过程破坏了纯水的电离平衡
B. 盐类的水解是酸碱中和反应的逆反应
C. 盐类水解后的溶液不一定显中性
D. ![]() 溶液中,
溶液中, ![]() 是
是![]() 的两倍
的两倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A.溴水中有下列平衡Br2+H2O![]() HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
B.加催化剂,使N2和H2在一定条件下转化为NH3
C.反应CO(g)+NO2(g)CO2(g)+NO(g) ΔH<0,达平衡后,升高温度体系颜色变深
D.增大压强,有利于SO2与O2反应生成SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,与盐类水解有关的是( )
①明矾可以做净水剂;
②实验室配制FeCl3溶液时,将FeCl3溶于少量的浓盐酸再加水稀释;
③用NaHCO3和Al2(SO4)3两种溶液可作泡沫灭火剂;
④在NH4Cl溶液中加入金属镁会产生氢气;
⑤草木灰与铵态氮肥不能混合施用;
⑥比较NH4Cl和Na2S等某些盐溶液的酸碱性.
A. ①④⑥ B. ②③⑤ C. ③④⑤ D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的转化在指定条件下能实现的是
①Cu![]() Cu2(OH)2CO3
Cu2(OH)2CO3![]() CuO
CuO
②CaCl2(aq) ![]() CaCO3
CaCO3![]() CaSiO3
CaSiO3
③MgO![]() MgCl2(aq)
MgCl2(aq) ![]() MgCl2(s)
MgCl2(s)
④N2![]() NO2
NO2![]() HNO3
HNO3
⑤Cl2![]() NaClO
NaClO![]() Cl2
Cl2
A.①④⑤B.①②⑤C.②③⑤D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,Ka(HCOOH) =1.77×10—4,Ka(CH3COOH) =1.75×10—5,下列说法正确的是
A. pH均为3的HCOOH和盐酸等体积混合后,pH变小
B. 0.2 molL—1 CH3COONa 与 0.1 molL﹣1盐酸等体积混合后的溶液中(pH<7):c(CH3COO—)>c(Cl—)>c(CH3COOH)>c(H+)
C. 0.2 molL—1 HCOOH 与 0.1 molL—1 NaOH 等体积混合后的溶液中:c(HCOO—) +c(HCOOH) =0.2 molL—1
D. 中和浓度和体积均相同的HCOOH和CH3COOH,所用NaOH的物质的量不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与社会、生产、生活密切相关,下列说法正确的是( )
A.![]() 可用于检验酒精中是否含有水
可用于检验酒精中是否含有水
B.![]() 是指大气中直径小于或等于
是指大气中直径小于或等于![]() 微米的颗粒物,与肺癌、哮喘等疾病的发生密切相关,是造成雾霾天气的主要原因
微米的颗粒物,与肺癌、哮喘等疾病的发生密切相关,是造成雾霾天气的主要原因
C.自来水厂用明矾净水,用![]() 或
或![]() 均能代替明矾净水
均能代替明矾净水
D.海洋植物具有富集碘的能力,因此从海产品中提取碘是工业上获取碘的重要途径,工业上从海带中提取碘的步骤有:灼烧![]() 浸泡
浸泡![]() 过滤
过滤![]() 萃取
萃取![]() 粗碘提纯
粗碘提纯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用纳米Fe/Ni复合材料能去除污染水体的NO3-,Ni不参与反应。离子在材料表面的活性位点吸附后发生反应,活性位点被其他附着物占据会导致速率减慢(NH4+无法占据活性位点)。反应过程如图所示:
(1)酸性环境中,纳米Fe/Ni去除NO3-分两步,将步骤ii补充完整:
Ⅰ.NO3-+Fe+2H+=NO2-+Fe2++H2O
Ⅱ.___+___+___H+=___Fe2++___+___
(2)初始pH=2.0的废液反应15min后,出现大量白色絮状物,过滤后很快变成红褐色,结合化学用语解释整个变化过程的原因___。
(3)水体初始pH会影响反应速率,不同pH的硝酸盐溶液与纳米Fe/Ni反应时,溶液中![]() 随时间的变化如图1所示。(注:c0(NO3-)为初始时NO3-的浓度。)
随时间的变化如图1所示。(注:c0(NO3-)为初始时NO3-的浓度。)

①为达到最高去除率,应调水体的初始pH=___。
②t<15min,pH=2.0的溶液反应速率最快,t>15min,其反应速率迅速降低,原因分别是___。
(4)总氮量指溶液中自由移动的所有含氮微粒浓度之和,纳米Fe/Ni处理某浓度硝酸盐溶液时,随时间的变化如图2所示。40min时总氮量较初始时下降,可能的原因是___。

(5)利用电解无害化处理水体中的NO3-,最终生成N2逸出。其装置及转化图如图所示:
①阴极的电极反应式为___。
②生成N2的离子方程式为___。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com