
【题目】下列物质的转化在指定条件下能实现的是
①Cu![]() Cu2(OH)2CO3
Cu2(OH)2CO3![]() CuO
CuO
②CaCl2(aq) ![]() CaCO3
CaCO3![]() CaSiO3
CaSiO3
③MgO![]() MgCl2(aq)
MgCl2(aq) ![]() MgCl2(s)
MgCl2(s)
④N2![]() NO2
NO2![]() HNO3
HNO3
⑤Cl2![]() NaClO
NaClO![]() Cl2
Cl2
A.①④⑤B.①②⑤C.②③⑤D.①②④
【答案】B
【解析】
![]() 与空气中的氧气和水以及二氧化碳反应生成铜绿,铜绿失水变成氧化铜;
与空气中的氧气和水以及二氧化碳反应生成铜绿,铜绿失水变成氧化铜;
![]() 氨气溶于水为碱性溶液,增大了二氧化碳的溶解度生成碳酸钙,碳酸钙高温与二氧化硅反应生成硅酸钙;
氨气溶于水为碱性溶液,增大了二氧化碳的溶解度生成碳酸钙,碳酸钙高温与二氧化硅反应生成硅酸钙;
![]() 氯化镁为强酸弱碱盐,氯化镁中存在镁离子的水解,加热促进其水解,最终得到氧化镁;
氯化镁为强酸弱碱盐,氯化镁中存在镁离子的水解,加热促进其水解,最终得到氧化镁;
![]() 氮气与氧气与生成NO;
氮气与氧气与生成NO;
![]() 氯气溶于氢氧化钠生成次氯酸钠,次氯酸钠与浓盐酸反应生成氯气,据此解答即可。
氯气溶于氢氧化钠生成次氯酸钠,次氯酸钠与浓盐酸反应生成氯气,据此解答即可。
![]() 与空气中的氧气和水以及二氧化碳反应生成铜绿,铜绿加热分解生成二氧化碳、水和氧化铜,故
与空气中的氧气和水以及二氧化碳反应生成铜绿,铜绿加热分解生成二氧化碳、水和氧化铜,故![]() 能实现;
能实现;
![]() 氨气溶于水为碱性溶液,二氧化碳在碱性溶液中溶解度增大,与氯化钙反应生成碳酸钙,碳酸钙高温与二氧化硅反应生成硅酸钙,故
氨气溶于水为碱性溶液,二氧化碳在碱性溶液中溶解度增大,与氯化钙反应生成碳酸钙,碳酸钙高温与二氧化硅反应生成硅酸钙,故![]() 能实现;
能实现;
![]() 氯化镁为强酸弱碱盐,氯化镁中存在镁离子的水解,
氯化镁为强酸弱碱盐,氯化镁中存在镁离子的水解,![]() ,由于HCl具有挥发性,加热促进水解,最终得到氢氧化镁,氢氧化镁加强热,分解生成MgO,故
,由于HCl具有挥发性,加热促进水解,最终得到氢氧化镁,氢氧化镁加强热,分解生成MgO,故![]() 不能实现;
不能实现;
![]() 氮气与氧气在放电条件下反应生成NO,氮气与氧气在放电条件下不能反应生成NO2,故
氮气与氧气在放电条件下反应生成NO,氮气与氧气在放电条件下不能反应生成NO2,故![]() 不能实现;
不能实现;
![]() 氯气溶于氢氧化钠生成次氯酸钠,次氯酸钠具有氧化性,浓盐酸具有还原性,两者发生归中反应生成氯气,故
氯气溶于氢氧化钠生成次氯酸钠,次氯酸钠具有氧化性,浓盐酸具有还原性,两者发生归中反应生成氯气,故![]() 能实现;故正确的是B,故选B。
能实现;故正确的是B,故选B。
①②⑤能够实现;
答案选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】常温下,现有氨水和盐酸两溶液。回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中 ________。(增大、减小、不变)
________。(增大、减小、不变)
(2)若向该氨水中加入氢氧化钠固体,则该电离平衡向_________方向移动(分子化、离子化),电离平衡常数______________。(增大、减小或不变)
(3)0.2 mol/L氨水和0.2 mol/L 盐酸溶液与等体积混合,溶液呈_____性 (酸、碱、中) ;其原因用离子方程式表示为__________________。混合液中,c(NH4+)+c(NH3H2O)=_______mol/L。(忽略体积变化)。请根据电荷守恒写出一个用离子浓度表示的等式_____________________。
(4)用0.1000mol/L HCl溶液滴定未知浓度的NaOH溶液,重复三次的实验数据如下所示
序号 | 0.100mol/L HCl溶液体积/mL | 待测NaOH溶液体积/mL |
1 | 27.83 | 25.00 |
2 | 26.53 | 25.00 |
3 | 27.85 | 25.00 |
该滴定可以使用的指示剂是__________;达到滴定终点时的现象是____________________。
待测NaOH溶液的物质的量浓度为_____________mol/L。(保留四位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸性废液中含有Fe2+、Cu2+、Ba2+三种金属离子,有同学设计了下列方案对废液进行处理(所加试剂均稍过量),以回收金属铜,保护环境。下列叙述错误的是( )
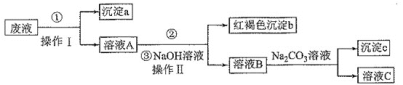
A.沉淀a中含有的单质是Cu、Fe
B.②的离子方程式是Fe2++H2O2+H+=Fe3++2H2O
C.操作Ⅱ用到的主要玻璃仪器有烧杯、漏斗、玻璃棒
D.溶液B中含有的阳离子主要是Ba2+、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液,一定呈中性的是
A. 由等体积、等物质的量浓度的硫酸跟NaOH溶液混合后所形成的溶液
B. c(H+)=1.0×10-7mol·L-1的溶液
C. pH=7的溶液
D. c(H+)=![]() 的溶液(Kw为该温度下水的离子积常数)
的溶液(Kw为该温度下水的离子积常数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活、社会密切相关,下列说法正确的是
A.利用海水制取氯化钠、烧碱、纯碱、氯气等物质都发生了氧化还原反应
B.蛋白质、葡萄糖、纤维素、油脂等都能在人体内水解并提供能量
C.为了提高生活用水的卫生标准,自来水厂常使用![]() 和
和![]() 进行消毒、净化、以改善水质
进行消毒、净化、以改善水质
D.塑料、合成橡胶和纤维这三大合成材料,都主要以石油、煤和天然气为原料生产的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)硅和氯两元素的单质反应生成1 mol Si的最高价化合物,恢复至室温,放热687 kJ,已知该化合物的熔、沸点分别为-69 ℃和58 ℃,写出该反应的热化学方程式___________________________________。
(2)肼(N2H4)可作为火箭发动机的燃料,与氧化剂 N2O4反应生成 N2 和水蒸气。
已知:①N2(g)+2O2(g)=N2O4(l) ΔH1=-19.5 kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2=-534.2 kJ·mol-1
写出肼和 N2O4反应的热化学方程式___________________。
(3)饮用水中的 NO3-主要来自 NH4+。已知在微生物的作用下,NH 4+经过两步反应被氧化成 NO3-。两步反应的能量变化示意图如图:
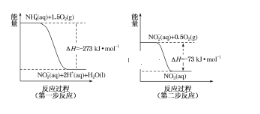
1mol NH 4+全部被氧化成 NO3-的热化学方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A.25℃ 101kPa时,CH4(g)+2O2(g)=CO2(g) +2H2O(g) △H=-Q kJ/mol,则甲烷的燃烧热为Q kJ/mol
B.CaCO3(s)=CaO(s)+CO2(g) 室温下不能自发进行,说明该反应的 ΔH<0
C.反应N2(g)+3H2(g)![]() 2NH3(g)ΔH<0达到平衡后,升高温度,反应速率v(H2)和H2的平衡转化率均增大
2NH3(g)ΔH<0达到平衡后,升高温度,反应速率v(H2)和H2的平衡转化率均增大
D.已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2的值均大于零):H2(g) +Cl2(g)=2HCl(g),△H1=—Q1 kJ/mol,H2(g) +Br2(g)=2HBr(g),△H2=—Q2 kJ/mol,则△H1<△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积固定的2L的密闭容器中,一定量的SO2与1mol O2在催化剂作用下加热到600℃发生反应:2SO2+O2![]() 2SO3;△H<0。当气体的物质的量减少0.2mol时反应达到平衡,在相同的温度下测得气体压强为反应前的8/9。下列有关叙述正确的是( )
2SO3;△H<0。当气体的物质的量减少0.2mol时反应达到平衡,在相同的温度下测得气体压强为反应前的8/9。下列有关叙述正确的是( )
A. 当SO3的生成速率与SO2的消耗速率相等时反应达到平衡
B. 降低温度,正反应速率减小程度比逆反应速率减小程度大
C. 将生成物SO3通入过量BaCl2溶液中,得到沉淀的质量为233g
D. 达到平衡时,平衡常数为2.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeSO4是一种补血剂,常温下久置易变黄,一般认为是二价铁被氧化为三价铁的缘故。
(1)已知:①Fe2+(aq)-e-= Fe3+(aq) △H1=akJ/mol
②O2(g)+4 e-+4H+(aq)=2H2O(l) △H2=bkJ/mol
则FeSO4在酸性溶液中变质的热化学方程式为_____ 。
常温下,配制浓度为0.1mol/L的FeSO4溶液,研究不同 pH 对Fe2+ 氧化的影响,结果如下图所示,(假设反应过程中溶液体积不变)。

(2)在pH=5.5的环境下,该反应在0~15min的平均速率v(Fe2+)=_______;增大溶液pH,Fe2+被氧化速率_______(填“增大”、“减小”或“无影响”)。
(3)在平衡常数的计算中气态物质常以压强代替其浓度,Fe2+在酸性环境下氧化的平衡常数K的计算表达式是______;常温下该反应的平衡常数很大,为2.5×1032L4 /(atmmol4),下列说法正确的是_______。
a. Fe2+转化为Fe3+的趋势大 b. Fe2+转化为Fe3+的速率大
c. 反应进行得较为彻底 d. 酸性条件下Fe2+不会被氧化
(4)在pH=13的环境下,Fe2+的氧化变质可以理解为:
第一步: Fe2++2OH-= Fe(OH)2,第二步_____________ (用化学方程式回答);当氧化达到平衡时,c(Fe2+)/ c(Fe3+)_____4.0×1022(填“>”“<”或“=”)。已知的Ksp[Fe(OH)3]=2.5×10-39,Ksp[Fe(OH)2]=1.0×10-15。
(5)根据上述分析,配制FeSO4溶液的正确方法是加入适量的铁粉和_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com