
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.NaCl(aq)![]() Cl2(g)
Cl2(g)![]() FeCl2(s)
FeCl2(s)
B.S(s)![]() SO3(g)
SO3(g)![]() H2SO4(aq)
H2SO4(aq)
C.Al(s)![]() AlCl3(aq)
AlCl3(aq)![]() Al(OH)3(s)
Al(OH)3(s)
D.N2(g)![]() NH3(g)
NH3(g)![]() Na2CO3(s)
Na2CO3(s)
科目:高中化学 来源: 题型:
【题目】在a LAl2(SO4)3和(NH4)2SO4的混合溶液中加入b mol BaCl2,恰好使溶液中的SO42-离子完全沉淀;如加入足量强碱并加热可得到c molNH3,则原溶液中的Al3+浓度(mol/L)为
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组用如图装置进行实验,试回答下列问题。

(1)若开始时开关K与a连接,则B极的电极反应式为_____________。
(2)若开始时开关K与b连接,总反应的离子方程式为_______。有关上述(2)实验,下列说法正确的是(填序号)____________。
①溶液中Na+向A极移动
②若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol 电子
③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
④从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
(3)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。

①该电解槽的阳极反应式为:_________________。
②制得的氢氧化钾溶液从出口(填写“A”、“B”、“C”、“D”)______导出。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是()
A.![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
B.由水电离的c(H+)=1×10-14mol/L的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
C.![]()
![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
D.![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
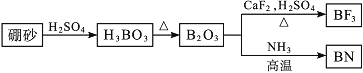
【题目】氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如图所示:
请回答下列问题:
(1)B和N相比,电负性较大的是___,BN中B元素的化合价为___;
(2)在BF3分子中,F—B—F的键角是___;BF3和过量NaF作用可生成NaBF4,BF4-的立体构型为___;
(3)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为___,层间作用力为___,六方相氮化硼晶体层内一个硼原子与相邻氮原子构成的空间构型为___,其结构与石墨相似却不导电,原因是___。
(4)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm。立方氮化硼晶胞中含有___个氮原子、___个硼原子,立方氮化硼的密度是___g·cm-3(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关从海带中提取碘的实验原理和装置能达到实验目的的是

A. 用装置甲灼烧碎海带
B. 用装置乙过滤海带灰的浸泡液
C. 用装置丙制备用于氧化浸泡液中I的Cl2
D. 用装置丁吸收氧化浸泡液中I后的Cl2尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组制备高铁酸钾(K2FeO4)并探究其性质。查阅文献,得到以下资料: K2FeO4为紫色固体,微溶于 KOH 溶液;具有强氧化性,在酸性或中性溶液中快速产生 O2,在碱性溶液中较稳定。
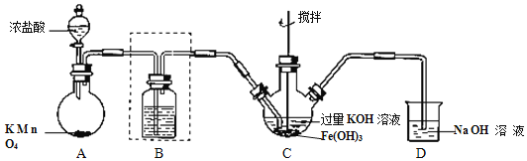
Ⅰ.制备 K2FeO4(夹持装置略)。
(1)A 为氯气的实验室发生装置。A 中反应方程式是______(锰被还原为 Mn2+)。若反应中有 0.5molCl2产生,则电子转移的数目为______。工业制氯气的反应方程式为______。
(2)装置 B 中盛放的试剂是______,简述该装置在制备高铁酸钾中的作用______。
(3)C 中得到紫色固体和溶液。C 中 Cl2发生的反应有:3Cl2+2Fe(OH)3+10KOH→2K2FeO4+6KCl+8H2O,根据该反应方程式得出:碱性条件下,氧化性 Cl2______FeO42-(填“>”或“<”)。另外C中还可能发生其他反应,请用离子方程式表示______。
Ⅱ.探究 K2FeO4 的性质
(4)甲同学取少量 K2FeO4 加入浑浊的泥浆水中,发现产生气体,搅拌,浑浊的泥浆水很快澄清。请简述 K2FeO4的净水原理。______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,现有氨水和盐酸两溶液。回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中 ________。(增大、减小、不变)
________。(增大、减小、不变)
(2)若向该氨水中加入氢氧化钠固体,则该电离平衡向_________方向移动(分子化、离子化),电离平衡常数______________。(增大、减小或不变)
(3)0.2 mol/L氨水和0.2 mol/L 盐酸溶液与等体积混合,溶液呈_____性 (酸、碱、中) ;其原因用离子方程式表示为__________________。混合液中,c(NH4+)+c(NH3H2O)=_______mol/L。(忽略体积变化)。请根据电荷守恒写出一个用离子浓度表示的等式_____________________。
(4)用0.1000mol/L HCl溶液滴定未知浓度的NaOH溶液,重复三次的实验数据如下所示
序号 | 0.100mol/L HCl溶液体积/mL | 待测NaOH溶液体积/mL |
1 | 27.83 | 25.00 |
2 | 26.53 | 25.00 |
3 | 27.85 | 25.00 |
该滴定可以使用的指示剂是__________;达到滴定终点时的现象是____________________。
待测NaOH溶液的物质的量浓度为_____________mol/L。(保留四位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸性废液中含有Fe2+、Cu2+、Ba2+三种金属离子,有同学设计了下列方案对废液进行处理(所加试剂均稍过量),以回收金属铜,保护环境。下列叙述错误的是( )
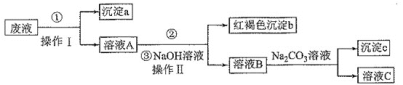
A.沉淀a中含有的单质是Cu、Fe
B.②的离子方程式是Fe2++H2O2+H+=Fe3++2H2O
C.操作Ⅱ用到的主要玻璃仪器有烧杯、漏斗、玻璃棒
D.溶液B中含有的阳离子主要是Ba2+、Na+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com