
【题目】现在污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚(![]() ),其原理如图所示,下列说法正确的是( )
),其原理如图所示,下列说法正确的是( )
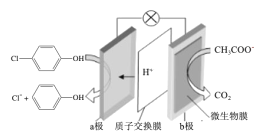
A.b为电池的正极,发生还原反应
B.电流从b极经导线、小灯泡流向a极
C.当外电路中有0.2mole-转移时,a极区增加的H+的个数为0.2NA
D.a极的电极反应式为:![]() +2e-+H+=Cl-+
+2e-+H+=Cl-+![]()
【答案】D
【解析】
原电池中阳离子移向正极,根据原电池中氢离子的移动方向可知a为正极,正极有氢离子参与反应,电极反应式为![]() +2e-+H+═
+2e-+H+═![]() +Cl-,电流从正极经导线流向负极,以此解答该题。
+Cl-,电流从正极经导线流向负极,以此解答该题。
A.a为正极,正极有氢离子参与反应,电极反应式为![]() +2e-+H+═
+2e-+H+═![]() +Cl-,发生还原反应,b为负极,物质在该极发生氧化反应,故A错误;
+Cl-,发生还原反应,b为负极,物质在该极发生氧化反应,故A错误;
B.由上述分析可知,电流从正极a沿导线流向负极b,故B错误;
C.据电荷守恒,当外电路中有0.2mole转移时,通过质子交换膜的H+的个数为0.2NA,而发生![]() +2e-+H+═
+2e-+H+═![]() +Cl-,则a极区增加的H+的个数为0.1NA,故C错误;
+Cl-,则a极区增加的H+的个数为0.1NA,故C错误;
D.a为正极,正极有氢离子参与反应,电极反应式为:![]() +2e-+H+═
+2e-+H+═![]() +Cl-,故D正确;
+Cl-,故D正确;
故答案为:D。


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:
【题目】烟气(主要污染物SO2、NOX)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中的SO2、NOx 的含量。
(1) O3氧化烟气中SO2、NOx 的主要反应的热化学方程式为: NO(g)+O3(g)![]() NO2(g)+ O2(g) ΔH=-200.9 kJ·mol-13NO(g)+O3(g)
NO2(g)+ O2(g) ΔH=-200.9 kJ·mol-13NO(g)+O3(g)![]() 3NO2(g) ΔH=-317.3kJ·mol-1。则2NO2(g)
3NO2(g) ΔH=-317.3kJ·mol-1。则2NO2(g)![]() 2NO(g)+O2(g)的ΔH=_____________kJ·mol-1
2NO(g)+O2(g)的ΔH=_____________kJ·mol-1
(2)T℃时,利用测压法在刚性反应器中,投入一定量的NO2发生反应3NO2(g)![]() 3NO(g)+O3(g),体系的总压强 p随时间 t的变化如下表所示:
3NO(g)+O3(g),体系的总压强 p随时间 t的变化如下表所示:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
压强/MPa | 20.00 | 21.38 | 22.30 | 23.00 | 23.58 | 24.00 | 24.00 |
①若降低反应温度,则平衡后体系压强 p______24.00 MPa(填“>”、“<”或“=”),原因是____________。
②15min 时,反应物的转化率 α=______。
③T℃时反应3NO2(g)![]() 3NO(g)+O3(g)的平衡常数Kp=____________(Kp 为以分压表示的平衡常数,分压等于总压乘以该气体的物质的量分数)
3NO(g)+O3(g)的平衡常数Kp=____________(Kp 为以分压表示的平衡常数,分压等于总压乘以该气体的物质的量分数)
(3)T℃时,在体积为2L的密闭刚性容器中,投入2 mol NO2发生反应2NO2(g)![]() 2NO(g)+O2(g),实验测得:v正=k正 c2(NO2),v逆=k逆 c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。在温度为T℃时NO2的转化率随时间变化的结果如图所示(反应在5.5min时达到平衡):
2NO(g)+O2(g),实验测得:v正=k正 c2(NO2),v逆=k逆 c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。在温度为T℃时NO2的转化率随时间变化的结果如图所示(反应在5.5min时达到平衡):

①在体积不变的刚性容器中,投入固定量的NO2发生反应,要提高NO2转化率,可采取的措施是______________、___________。
②由图中数据,求出该反应的平衡常数为_________。
③计算A 点处v正/v逆=_________________________(保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.为探究铜与稀硝酸反应的气态产物中是否含NO2,进行如下实验。
已知: FeSO4+NO→[Fe(NO)]SO4,该反应较缓慢,待生成一定量[Fe(NO)]2+时突显明显棕色。

(1)实验前需检验装置的气密性,简述操作_____________________________________。
(2)实验开始时先将Y形试管向盛有碳酸钙的支管倾斜,缓慢滴入稀硝酸,该实验操作的目的是__________________________________________________________________;铜片和稀硝酸反应的化学方程式为________________________________。
(3)洗气瓶中加入KSCN溶液的目的及原理是______________________________________;本实验只观察到洗气瓶中出现了棕色,写出尾气处理的化学方程式________________。
.实验室制备的CuSO4·5H2O中常含Cu(NO3)2,用重量法测定CuSO4·5H2O的含量。
(4)实验步骤为:①___________②加水溶解③加氯化钡溶液,沉淀④过滤(其余步骤省略),在过滤前,需要检验是否沉淀完全,其操作是_________________________________。
(5)若1.040 g试样中含CuSO4·5H2O的准确值为1.015 g,而实验测定结果是l.000 g 测定的相对误差为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)“一氧化碳变换”是合成氨原料气生产中的重要环节,其反应方程式为:CO(g)+H2O(g)![]() CO2(g)+H2(g)。将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
CO2(g)+H2(g)。将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
CO | H2O | CO2 | CO | |||
1 | 650 | 4 | 2 | 1.6 | 2.4 | 5 |
2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
3 | 650 | 2 | 1 | A | B | t |
①实验1中从反应开始到达到平衡,以H2的浓度变化表示的反应速率为_________
②A=_________
③平衡常数:K(900℃)_________K(650℃)(填“>”、“<”或“=”).
(2)温度是一氧化碳变换中最重要的工艺条件,实际生产过程中将温度控制在400℃左右,可能的原因是__________。
(3)下列描述中能说明上述反应已达平衡的是___________________
a.v正(CO)=v逆(H2) b.气体的密度不随时间而变化
c.H2和CO2的比例保持不变 d.气体的压强不再发生变化
(4)C、H、O、N元素中,写出两两组合(不能重复)形成的非极性分子的电子式_________,极性分子的电子式_________。这四种元素形成的化合物_________(填“一定是”、“一定不是”、“不一定是”)离子化合物。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠离子电池由于成本低、资源丰富,成为取代锂离子电池在大规模储能领域应用的理想选择。作为钠离子电池的正极材料之一,束状碳包覆K3V2(PO4)3纳米线电极材料成为关注焦点之一。其制备工艺流程如图:
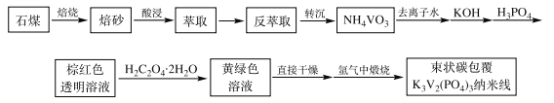
(资料)
①石煤的主要成分为V2O3,含有Al2O3、CaO、Fe2O3等杂质。
②+5价钒在溶液中的主要存在形式与溶液pH的关系如下表。
![]()
(1)K3V2(PO4)3中V的化合价为___。
(2)焙烧时,向石煤中加生石灰,将V2O3转化为Ca(VO3)2。
①为了提高焙烧过程中氧化效率,下述工艺步骤方法合理的是___。
a.在回转窑进行富氧焙烧,助燃风气量为煤气量的0.5~2倍
b.焙烧过程中,在焙烧物料中加入辅助剂,增加物料疏松度和透气性
c.窑体进行分段控温
d.调控料层厚度为窑体的2/3高度
②焙烧过程中主要反应的化学方程式为__________。
(3)实验时将NH4VO3、KOH和H3PO4按物质的量分别为5mmol、7.5mmol、7.5mmol依次溶解于20mL去离子水中,溶液颜色依次为白色浑浊、无色澄清透明和棕红色透明溶液。随后再加入H2C2O4·2H2O,搅拌至溶液变为黄绿色,草酸的量对K3V2(PO4)3形貌的影响如下:

①实验条件下束状碳包覆K3V2(PO4)3纳米线样品制备的最佳条件为___。
②亚硫酸钠是常用的还原剂,但实验中不能用亚硫酸钠代替草酸晶体,原因是___。
(4)加入的草酸晶体是过量的,其中只有![]() 的草酸为还原剂,将VO3-还原成VO2+,
的草酸为还原剂,将VO3-还原成VO2+,![]() 的草酸以C2O42-的形式存在,此过程中反应的离子方程式为___。
的草酸以C2O42-的形式存在,此过程中反应的离子方程式为___。
(5)“氩气中煅烧”时,氩气的作用是___。
(6)某工厂利用上述工艺流程,用10t石煤生产束状碳包覆K3V2(PO4)3纳米线0.8064t,若整个过程中钒的总回收率为80%,则石煤中钒元素的质量分数为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】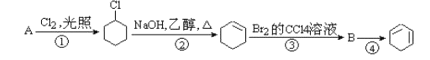
(1)A的结构简式是_____,名称是_____。①的反应类型是_____,③的反应类型是_____。
(2)反应②的化学方程式是_____。
(3)反应④的化学方程式是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加热聚丙烯废塑料可以得到碳、氢气、甲烷、乙烯、丙烯、苯和甲苯。用如图所示装置探究废旧塑料的再利用。下列叙述不正确的是
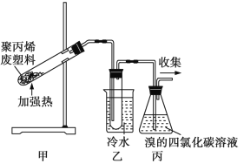
A.装置乙试管中收集到的液体在催化剂存在下可以与Br2发生取代反应
B.装置丙中的试剂吸收反应产生的气体后得到的产物的密度均比水大
C.最后收集的气体可以作为清洁燃料使用
D.甲烷的二氯代物有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一:焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3+SO2![]() Na2S2O5。
Na2S2O5。
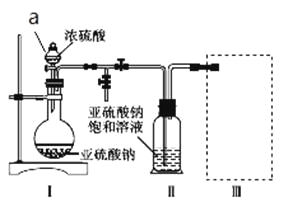
(1)加试剂前要进行的操作是_______________。装置Ⅰ中产生气体的化学方程式为____________。
(2)浓硫酸_______________ (填“能”或“不能”)用稀硫酸代替,原因是_______________。
(3)从装置Ⅱ中分离出产品可采取的分离方法是_______________________。
(4)为了完整实验装置,在下列装置中选择一个最合理的装置放在装置Ⅲ处,可选用的装置(夹持仪器已略去)为___________(填序号)。
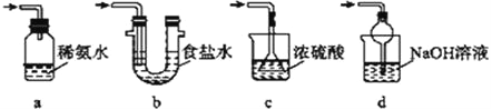
实验二:葡萄酒中抗氧化剂残留量的测定
(5)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O![]() H2SO4+2HI)
H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液30.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为________________g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测定结果______________(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是生活中常见的金属,铜及其化合物在不同环境中能呈现出不同的颜色:
![]()
回答下列问题:
(1)Cu基态核外电子排布式为___;科学家通过X射线测得Cu(H2O)4SO4·H2O结构示意图可简单表示如图:

图中虚线表示的作用力为___。
(2)已知Cu+(SCN)2![]() Cu+(SCN)2,1mol(SCN)2分子中含有的π键数目为___,写出2个与SCN-互为等电子体的分子的化学式___。
Cu+(SCN)2,1mol(SCN)2分子中含有的π键数目为___,写出2个与SCN-互为等电子体的分子的化学式___。
(3)金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是___,反应的化学方程式为___。
(4)在Cu(H2O)4SO4·H2O晶体中,[Cu(NH3)4]2+为平面正方形结构,则呈正四面体结构的原子团是___,其中心原子的杂化轨道类型是___。
(5)已知Cu的晶胞结构如图所示,铜原子的配位数为___,又知晶胞边长为3.61×10-8cm,则Cu的密度为___ (保留三位有效数字)。
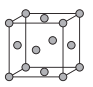
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com