
����Ŀ�������ӵ�����ڳɱ��͡���Դ�ḻ����Ϊȡ������ӵ���ڴ��ģ��������Ӧ�õ�����ѡ����Ϊ�����ӵ�ص���������֮һ����״̼����K3V2(PO4)3�����ߵ缫���ϳ�Ϊ��ע����֮һ�����Ʊ�����������ͼ��
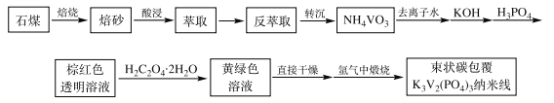
�����ϣ�
��ʯú����Ҫ�ɷ�ΪV2O3������Al2O3��CaO��Fe2O3�����ʡ�
��+5�۷�����Һ�е���Ҫ������ʽ����ҺpH�Ĺ�ϵ���±���
![]()
��1��K3V2(PO4)3��V�Ļ��ϼ�Ϊ___��
��2������ʱ����ʯú�м���ʯ�ң���V2O3ת��ΪCa(VO3)2��
��Ϊ����߱��չ���������Ч�ʣ��������ղ��跽����������___��
a.�ڻ�תҤ���и������գ���ȼ������Ϊú������0.5~2��
b.���չ����У��ڱ��������м��븨�����������������ɶȺ�����
c.Ҥ����зֶο���
d.�����ϲ���ΪҤ���2/3�߶�
�ڱ��չ�������Ҫ��Ӧ�Ļ�ѧ����ʽΪ__________��
��3��ʵ��ʱ��NH4VO3��KOH��H3PO4�����ʵ����ֱ�Ϊ5mmol��7.5mmol��7.5mmol�����ܽ���20mLȥ����ˮ�У���Һ��ɫ����Ϊ��ɫ���ǡ���ɫ���������غ�ɫ����Һ������ټ���H2C2O4��2H2O����������Һ��Ϊ����ɫ�����������K3V2(PO4)3��ò��Ӱ�����£�

��ʵ����������״̼����K3V2(PO4)3��������Ʒ�Ʊ����������Ϊ___��
�����������dz��õĻ�ԭ������ʵ���в������������ƴ�����ᾧ�壬ԭ����___��
��4������IJ��ᾧ���ǹ����ģ�����ֻ��![]() �IJ���Ϊ��ԭ������VO3-��ԭ��VO2+��
�IJ���Ϊ��ԭ������VO3-��ԭ��VO2+��![]() �IJ�����C2O42-����ʽ���ڣ��˹����з�Ӧ�����ӷ���ʽΪ___��
�IJ�����C2O42-����ʽ���ڣ��˹����з�Ӧ�����ӷ���ʽΪ___��
��5���������������ʱ�������������___��
��6��ij�������������������̣���10tʯú������״̼����K3V2(PO4)3������0.8064t�������������з����ܻ�����Ϊ80%����ʯú�з�Ԫ�ص���������Ϊ___��
���𰸡�+3 a��b��c ![]() ��������Ϊ6.0g �����ںϳ���״̼����K2V2(PO4)3�����ߵĹ����в�������ԭ����Ӱ������ò
��������Ϊ6.0g �����ںϳ���״̼����K2V2(PO4)3�����ߵĹ����в�������ԭ����Ӱ������ò ![]() ��ֹK2V2(PO4)3������ 2.04%
��ֹK2V2(PO4)3������ 2.04%
��������
ʯú����Ҫ�ɷ�ΪV2O3������Al2O3��CaO��Fe2O3�����ʣ��ڿ����б��գ�����Ca(VO3)2������������������Fe3+��Al3+��Ca2+��![]() �ȣ�������ȡ������
�ȣ�������ȡ������![]() ��������ȡ��Ȼ����з���ȡ��������
��������ȡ��Ȼ����з���ȡ��������![]() �������ᴿ����������Һ�м������������NH4VO3��NH4VO3��KOH��H3PO4��Ӧ��õ��غ�ɫ����
�������ᴿ����������Һ�м������������NH4VO3��NH4VO3��KOH��H3PO4��Ӧ��õ��غ�ɫ����![]() ��Һ��Ȼ������Һ�м���������ᾧ�巢��������ԭ��Ӧ����
��Һ��Ȼ������Һ�м���������ᾧ�巢��������ԭ��Ӧ����![]() ��ԭ��VO2+��Ȼ����и��������������������Ʊ���״̼����K3V2(PO4)3�����ߣ��Դ˽��
��ԭ��VO2+��Ȼ����и��������������������Ʊ���״̼����K3V2(PO4)3�����ߣ��Դ˽��
��1��K3V2(PO4)3��KԪ�ػ��ϼ�Ϊ+1�ۣ�![]() ��3����λ����ɣ����ݻ����ﻯ�ϼ�Ϊ0��֪��V��+3�ۣ�
��3����λ����ɣ����ݻ����ﻯ�ϼ�Ϊ0��֪��V��+3�ۣ�
��2����a�����չ�����VԪ�ر��������ڸ��������б����������������Ч�ʣ���a�������⣻
b�������������ɶȺ����Կ���߹��巴Ӧ��Ч���Լ���Ӧ���ʣ����������Ч�ʣ���b�������⣻
c���ֶο��¿ɷ�ֹ���ȵ��¹����飬���������Ч�ʣ���c�������⣻
d�����ϲ��ȹ��ߣ������ڷ�Ӧ�ij�ֽ��У�����轵���ϲ�ĺ�ȣ���d���������⣻
�ʴ�Ϊ��a��b��c��
�ڱ��չ�����V2O3ת��ΪCa(VO3)2��VԪ�ػ��ϼ����ߣ���˿�����O2�μӷ�Ӧ���䷴Ӧ����ʽΪ��![]() ��
��
��3�����ɱ����֪����Ҫ�Ʊ�����һ����״K3V2(PO4)3�����ߣ���������Ϊ6.0g��
�ڲ����ںϳɹ���������ԭ�����ɱ����֪�����ᾧ���ʹ������ͬ�������ߵ���òҲ�ᷢ���ñ䣬���ѡ�ò��ᾧ��������������Ƶ�ԭ��Ϊ�������ںϳ���״̼����K2V2(PO4)3�����ߵĹ����в�������ԭ����Ӱ������ò��
��4������ֻ��![]() �IJ���Ϊ��ԭ�������ᱻ����ΪCO2������
�IJ���Ϊ��ԭ�������ᱻ����ΪCO2������![]() ��ԭ��VO2+��
��ԭ��VO2+��![]() �IJ�����
�IJ�����![]() ����ʽ���ڣ�����������ԭת�Ƶ����غ㡢����غ��Լ�ԭ���غ��֪�����ӷ�Ӧ����ʽΪ��
����ʽ���ڣ�����������ԭת�Ƶ����غ㡢����غ��Լ�ԭ���غ��֪�����ӷ�Ӧ����ʽΪ��![]() ��
��
��5��K3V2(PO4)3��V��+3�ۣ����ױ�������������������������������������ֹK3V2(PO4)3��������
��6����ʯú�з�Ԫ�ص���������Ϊ![]() ����������������VԪ�������غ�ɵã�
����������������VԪ�������غ�ɵã�
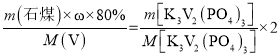 ��
��![]() =
=![]() �����
�����![]() =0.0204����ʯú�з�Ԫ�ص���������Ϊ2.04%��
=0.0204����ʯú�з�Ԫ�ص���������Ϊ2.04%��


 ���ٴ�����ɽ����ϵ�д�
���ٴ�����ɽ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪijƯ���Ľṹ����֪��W��Y��Z�Dz�ͬ���ڡ���ͬ����Ķ�����Ԫ�أ�W��Y��Zԭ������������֮�͵���Xԭ��������������W��X��Ӧ�ļ����Ӻ�������Ų���ͬ�����������������ǣ� ��
![]()
A.W��X��Ӧ�ļ����ӵİ뾶��X>W
B.���W���Ȼ���ˮ��Һ�����Ƶ�W����
C.ʵ���ҿ���X��Z�γɵ�ij�ֻ�������ȡ����X
D.25��ʱ��Y������������Ӧˮ�����������ҺpH����7
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������SnCl2��SnCl4�����Ȼ��SnCl4����ɫҺ�壬����ˮ�⣬�۵㩁36�棬�е�114�棬���������۵�Ϊ231�森ʵ���������ڵĽ����������������ֱ��������ȡ��ˮSnCl4���˷�Ӧ���̷ų��������ȣ���ʵ������ȡ��ˮSnCl4��װ����ͼ��ʾ��
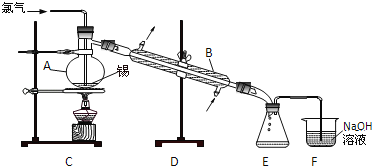
���������գ�
��1������A������__�� ����B������__��
��2��ʵ�����Ƶõ������к�HCl��ˮ�������뾻������ͨ��Һ̬���з�Ӧ����ȥHCl��ԭ�������__����ȥˮ��ԭ����__��
��3�������ۻ���ͨ��������ʼ��Ӧ������ֹͣ���ȣ���ԭ����__������Ӧ����ȥ����11.9g����Ӧ������ƿ���ռ���23.8g SnCl4����SnCl4�IJ���Ϊ__��
��4��SnCl4��ˮǿ��ˮ��IJ���֮һ�ǰ�ɫ�Ĺ�̬��������������SnCl4������¶�ڳ�ʪ�����У�Ԥ�ڿɿ�����������__��
��5����֪��ԭ��Sn2+��I����SnCl2Ҳ��ˮ���������ܵ�Sn��OH��Cl����μ����Ƶõ�SnCl4��Ʒ���Ƿ����������SnCl2��__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Һ���ζ�NaOH����Һ�����в������ܻ�ʹ�ⶨ���ƫ�͵���
A. ��ʽ�ζ���ֻ��ˮϴ
B. ��ƿֻ��ˮϴ
C. ʹ�ü�����ָʾ��
D. ��һ�ι۲���ʽ�ζ��ܵĿ̶�ʱ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)ͭ�����������Ԫ�أ�Ҳ������㷺ʹ�õĽ������ִ���ҵ�ϣ���Ҫ���ø���ұ����ͭ��CuFeS2��Ҳ�ɱ�ʾΪCu2SFe2S3���ķ������ͭ������ͭ����Ҫ���ջ�ͭ��2CuFeS2��4O2![]() Cu2S��3SO2��2FeO����Ӧ�б���ԭ��Ԫ����_________��ÿת��0.6mol���ӣ���_________mol��������
Cu2S��3SO2��2FeO����Ӧ�б���ԭ��Ԫ����_________��ÿת��0.6mol���ӣ���_________mol��������
(2)�����е�SO2��һ�ִ�����Ⱦ���ѡ�������Լ��е�_________���գ�ѡ���ţ���
a��ŨH2SO4b��ϡHNO3c��NaOH��Һd��CaCl2
(3)Cu2OͶ��������ijŨ�ȵ������У��������������ΪNO��NO2�Ļ����������Ϊ1�s1��������Ӧ�Ļ�ѧ����ʽΪ��____________________________________��
(4)ijͬѧͨ���绯ѧԭ��ʵ��������ת����Cu+2H+��Cu2++H2������H2��_________����ã���д�缫���ƣ���
(5)���Ȼ�ͭ���Ȼ����Ļ����Һ�м�������ͭ��ĩ������µij�����д���ó����Ļ�ѧʽ_________������ƽ���ƶ���ԭ������ϱ�Ҫ�����ӷ���ʽ���Դ�������������______��
(6)��SO2����ͨ��CuCl2��Һ�У�����CuCl������ͬʱ�����в���_________����д��ѧʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ˮ����Խ��Խ�����������ӣ�����ͨ��Ĥ��س�ȥ��ˮ�е������ƺͶ��ȱ��ӣ�![]() ������ԭ����ͼ��ʾ������˵����ȷ���ǣ� ��
������ԭ����ͼ��ʾ������˵����ȷ���ǣ� ��
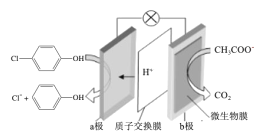
A.bΪ��ص�������������ԭ��Ӧ
B.������b�������ߡ�С��������a��
C.�����·����0.2mole-ת��ʱ��a�������ӵ�H+�ĸ���Ϊ0.2NA
D.a���ĵ缫��ӦʽΪ��![]() +2e-+H+=Cl-+
+2e-+H+=Cl-+![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ĩ���ǰ������ֱ���Ϊ��������ϩ�����ӻ����黯��C��H��������Ӧ�Լ����ٽ����ɵ������ӵ������������ת����Ӧ�еĹؼ��м��塣��������Խ��������ĺϳɡ���ѧ�����ͷ�Ӧ���ʵ��о�һֱ�ǻ�ѧ���ǹ�ע���ص㡣�ҹ���ѧ�ҳɹ�ʵ������������λ�Ķ�������ĩ���ǰ��������ĺϳɡ��ش������й����⡣
��1��Fe2+�ļ۵����Ų�ʽ___��
��2��1molNH4BF4��������泥��к��е���λ������___��
��3��pH=6ʱ��EDTA�ɵζ���Һ��Fe2+�ĺ�����EDTA�Ľṹ��ͼ��ʾ��
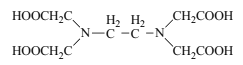
�ٽṹ�е縺������Ԫ����___������C��Nԭ�ӵ��ӻ���ʽ�ֱ�Ϊ___��___��
��EDTA������ֽ����������γ��ȶ�������ԭ����___��
��4���ҹ���ѧ�ҽ����Ʊ����ȶ���ѧ�ȶ��ĺ�-�ƻ�����侧���ṹ��ͼ��ʾ��
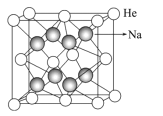
�ٸû�����Ļ�ѧʽΪ___��
���侧������Ϊa=395pm�������ܶ�Ϊ___g/cm3��NA��ʾ�����ӵ�������ֵ���г�����ʽ���ɣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�о����֣��߶ȶԳƵ��л����Ӿ��������Ըߡ��ȶ���ǿ�������ܴ���ص㡣����������һϵ�и߶ȶԳƽṹ��������![]() ������������C4H4����
������������C4H4����![]() ���⾧��C6H6����
���⾧��C6H6����![]() ��������C8H8���������й�˵����ȷ����
��������C8H8���������й�˵����ȷ����
A.�������������е�Cԭ�Ӷ��γ�4��������������Ƕ���������
B.�����������ʻ�Ϊͬϵ����ǵ�ͨʽΪC2nH2n��n��2��
C.�⾧������������̼ԭ�Ӿ�Ϊ����̼ԭ�ӣ�����ȴ������Ŀ��ͬ
D.�⾧�����������ڹ��������¾�������������ȡ����Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.1mol/LNaOH��Һ�ֱ�ζ������Ϊ20mL��Ũ�Ⱦ�Ϊ0.1mol/LHCl��Һ��HX��Һ����Һ��pH������NaOH��Һ����仯��ͼ������˵����ȷ����
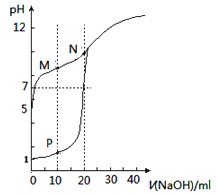
A. M��c(HX)-c(X-)>c(OH-)-c(H+)
B. N���pH>7��ԭ��������NaOH��������
C. HXΪ���ᣬ�ҵ���ƽ�ⳣ��Ka��1��10-10
D. P��c(Cl-)=0.05mol/L
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com