
【题目】(1)铜是生命必需的元素,也是人类广泛使用的金属。现代工业上,主要采用高温冶炼黄铜矿(CuFeS2,也可表示为Cu2SFe2S3)的方法获得铜。火法炼铜首先要焙烧黄铜矿:2CuFeS2+4O2![]() Cu2S+3SO2+2FeO,反应中被还原的元素有_________,每转移0.6mol电子,有_________mol硫被氧化。
Cu2S+3SO2+2FeO,反应中被还原的元素有_________,每转移0.6mol电子,有_________mol硫被氧化。
(2)产物中的SO2是一种大气污染物,可选用下列试剂中的_________吸收(选填编号)。
a.浓H2SO4b.稀HNO3c.NaOH溶液d.CaCl2
(3)Cu2O投入足量的某浓度的硝酸中,若所得气体产物为NO和NO2的混合物,且体积比为1﹕1,发生反应的化学方程式为:____________________________________。
(4)某同学通过电化学原理实现了如下转化:Cu+2H+→Cu2++H2↑,则H2在_________极获得(填写电极名称)。
(5)向氯化铜和氯化铁的混合溶液中加入氧化铜粉末会产生新的沉淀,写出该沉淀的化学式_________。请用平衡移动的原理,结合必要的离子方程式,对此现象作出解释______。
(6)将SO2气体通入CuCl2溶液中,生成CuCl沉淀的同时,还有产物_________(填写化学式)。
【答案】Fe,O 0.1 c 2Cu2O+10HNO3→4Cu(NO3)2+NO↑+NO2↑+5H2O 阴 Fe(OH)3 因为Fe3+会水解产生较多的H+:Fe3++3H2O![]() Fe(OH)3+3H+,加入CuO与H+反应生成Cu2+和H2O,降低了H+浓度,使得水解平衡正向移动,生成Fe(OH)3沉淀 HCl,H2SO4
Fe(OH)3+3H+,加入CuO与H+反应生成Cu2+和H2O,降低了H+浓度,使得水解平衡正向移动,生成Fe(OH)3沉淀 HCl,H2SO4
【解析】
2CuFeS2+4O2![]() Cu2S+3SO2+2FeO中,铁和氧元素的化合价降低,硫元素的化合价升高,利用化合价变化计算被氧化的硫;铜元素的化合价为+1,升高为+2价,气体产生为一氧化氮和二氧化氮的混合物,得到电子数为4,氧化亚铜失去电子数为2,结合电子守恒及原子守恒分析。
Cu2S+3SO2+2FeO中,铁和氧元素的化合价降低,硫元素的化合价升高,利用化合价变化计算被氧化的硫;铜元素的化合价为+1,升高为+2价,气体产生为一氧化氮和二氧化氮的混合物,得到电子数为4,氧化亚铜失去电子数为2,结合电子守恒及原子守恒分析。
(1) 2CuFeS2+4O2![]() Cu2S+3SO2+2FeO,CuFeS2可表示为Cu2SFe2S3,即铜的化合价为+1,铁的化合价为+3,硫的化合价为-2,氧气作为氧化剂,反应中被还原的元素有铁和氧元素,每转移0.6mol电子,有0.1mol硫被氧化。
Cu2S+3SO2+2FeO,CuFeS2可表示为Cu2SFe2S3,即铜的化合价为+1,铁的化合价为+3,硫的化合价为-2,氧气作为氧化剂,反应中被还原的元素有铁和氧元素,每转移0.6mol电子,有0.1mol硫被氧化。
(2) a.浓H2SO4具有吸水性,不吸收二氧化硫,a错误;
b.稀HNO3具有氧化性,能与二氧化硫反应,但产物均有毒性,b错误;
c.NaOH溶液显碱性,能大量吸收二氧化硫,c正确;
d.CaCl2与二氧化硫不反应,d错误。
答案为C。
(3根据描述,发生反应的化学方程式为:2Cu2O+10HNO3=4Cu(NO3)2+NO↑+NO2↑+5H2O。
(4)某同学通过电化学原理实现了如下转化:Cu+2H+→Cu2++H2↑,氢离子得电子发生还原反应,属于阴极,则H2在阴极获得。
(5)向氯化铜和氯化铁的混合溶液中为酸性,加入氧化铜粉末后,氧化铜与溶液中的氢离子反应,促使铁离子的水解正向移动,产生氢氧化铁沉淀。详细解释为:因为Fe3+会水解产生较多的H+:Fe3++3H2O![]() Fe(OH)3+3H+,加入CuO与H+反应生成Cu2+和H2O,降低了H+浓度,使得水解平衡正向移动,生成Fe(OH)3沉淀。
Fe(OH)3+3H+,加入CuO与H+反应生成Cu2+和H2O,降低了H+浓度,使得水解平衡正向移动,生成Fe(OH)3沉淀。
(6)将SO2气体通入CuCl2溶液中,二氧化硫具有还原性,生成CuCl沉淀,铜化合价降低,故硫的化合价升高,产物还有HCl,H2SO4。


 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案科目:高中化学 来源: 题型:
【题目】常温下,向1 L 0.1 mol·L-1 NH4Cl溶液中,不断加入固体NaOH后,NH![]() 与NH3 · H2O的变化趋势如下图所示(不考虑体积变化和氨的挥发),下列说法不正确的是( )
与NH3 · H2O的变化趋势如下图所示(不考虑体积变化和氨的挥发),下列说法不正确的是( )
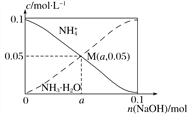
A. 在M点时,n(OH-)-n(H+)=(a-0.05) mol
B. 随着NaOH的加入,![]() 不断增大
不断增大
C. M点溶液中水的电离程度比原溶液小
D. 当n(NaOH)=0.1 mol时,c(OH-)>c(Cl-)-c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关常温下0.1 mol/L氨水(pH=11)的说法正确的是
A.该氨水显弱碱性
B.加水稀释过程中,![]() 的值减小
的值减小
C.与同温下pH=11的NaOH溶液相比,NaOH溶液中c(Na+)大于氨水中c(NH4+)
D.加入少量NH4Cl 固体,溶液中水的电离平衡:H2O![]() H+ + OH―向右移动
H+ + OH―向右移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,不能用勒夏特列原理解释的是
A. 红棕色的NO2,加压后颜色先变深后变浅
B. 高压比常压有利于合成SO3的反应
C. 加入催化剂有利于氨的合成
D. 工业制取金属钾Na(l)+KCl(l)![]() NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2—CaO作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛。下列说法中不正确的是( )
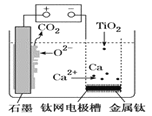
A.由TiO2制得1mol金属Ti,理论上外电路转移4mol电子
B.阳极的电极反应式为2O2--4e-=O2↑
C.在制备金属钛前后,整套装置中CaO的总量会不断减少
D.装置中石墨电极材料需要定期更换
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠离子电池由于成本低、资源丰富,成为取代锂离子电池在大规模储能领域应用的理想选择。作为钠离子电池的正极材料之一,束状碳包覆K3V2(PO4)3纳米线电极材料成为关注焦点之一。其制备工艺流程如图:
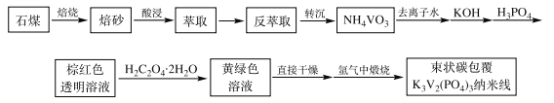
(资料)
①石煤的主要成分为V2O3,含有Al2O3、CaO、Fe2O3等杂质。
②+5价钒在溶液中的主要存在形式与溶液pH的关系如下表。
![]()
(1)K3V2(PO4)3中V的化合价为___。
(2)焙烧时,向石煤中加生石灰,将V2O3转化为Ca(VO3)2。
①为了提高焙烧过程中氧化效率,下述工艺步骤方法合理的是___。
a.在回转窑进行富氧焙烧,助燃风气量为煤气量的0.5~2倍
b.焙烧过程中,在焙烧物料中加入辅助剂,增加物料疏松度和透气性
c.窑体进行分段控温
d.调控料层厚度为窑体的2/3高度
②焙烧过程中主要反应的化学方程式为__________。
(3)实验时将NH4VO3、KOH和H3PO4按物质的量分别为5mmol、7.5mmol、7.5mmol依次溶解于20mL去离子水中,溶液颜色依次为白色浑浊、无色澄清透明和棕红色透明溶液。随后再加入H2C2O4·2H2O,搅拌至溶液变为黄绿色,草酸的量对K3V2(PO4)3形貌的影响如下:

①实验条件下束状碳包覆K3V2(PO4)3纳米线样品制备的最佳条件为___。
②亚硫酸钠是常用的还原剂,但实验中不能用亚硫酸钠代替草酸晶体,原因是___。
(4)加入的草酸晶体是过量的,其中只有![]() 的草酸为还原剂,将VO3-还原成VO2+,
的草酸为还原剂,将VO3-还原成VO2+,![]() 的草酸以C2O42-的形式存在,此过程中反应的离子方程式为___。
的草酸以C2O42-的形式存在,此过程中反应的离子方程式为___。
(5)“氩气中煅烧”时,氩气的作用是___。
(6)某工厂利用上述工艺流程,用10t石煤生产束状碳包覆K3V2(PO4)3纳米线0.8064t,若整个过程中钒的总回收率为80%,则石煤中钒元素的质量分数为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我们已经学习了几种典型的有机化学反应类型,写出下列反应的化学反应方程式,并判断其反应类型。
(1)由乙醇制乙烯_____属于_____反应。
(2)由苯制取硝基苯_____属于_____反应。
(3)由乙醇制乙醛_____属于_____反应。
(4)由丙烯腈(CH2=CH-CN)制备聚丙烯腈(人造羊毛的主要成分):_____,属于_____反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过资源化利用的方式将CO2转化为具有工业应用价值的产品(如图所示),是一种较为理想的减排方式,下列说法中正确的是( )
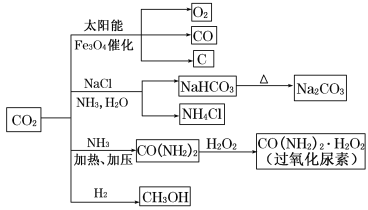
A.CO2经催化分解为C、CO、O2的反应为放热反应
B.除去Na2CO3固体中少量NaHCO3可用热分解的方法
C.过氧化尿素和SO2都能使品红溶液褪色,其原理相同
D.由CO2和H2合成甲醇,原子利用率达100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于难溶电解质溶解平衡的说法正确的是
A. 可直接根据 Ksp 的数值大小比较难溶电解质在水中的溶解度大小
B. 在 AgCl 的饱和溶液中,加入蒸馏水, Ksp(AgCl)不变
C. 难溶电解质的溶解平衡过程是可逆的,且在平衡状态时 v溶解=v沉淀=0
D. 25℃时, Ksp(AgCl)>Ksp(AgI),向 AgCl 的饱和溶液中加入少量 KI 固体,一定有黄色沉
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com