
【题目】焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一:焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3+SO2![]() Na2S2O5。
Na2S2O5。
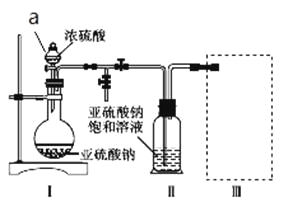
(1)加试剂前要进行的操作是_______________。装置Ⅰ中产生气体的化学方程式为____________。
(2)浓硫酸_______________ (填“能”或“不能”)用稀硫酸代替,原因是_______________。
(3)从装置Ⅱ中分离出产品可采取的分离方法是_______________________。
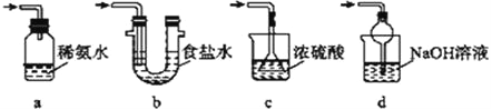
(4)为了完整实验装置,在下列装置中选择一个最合理的装置放在装置Ⅲ处,可选用的装置(夹持仪器已略去)为___________(填序号)。
实验二:葡萄酒中抗氧化剂残留量的测定
(5)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O![]() H2SO4+2HI)
H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液30.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为________________g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测定结果______________(填“偏高”、“偏低”或“不变”)。
【答案】 检查装置的气密性 Na2SO3+H2SO4(浓)== Na2SO4+SO2↑+H2O 不能 如用稀硫酸,则生成的二氧化硫会溶解在溶液中而难以逸出 过滤 d 0.192 偏低
【解析】(1)加试剂前要进行的操作是检查装置的气密性;装置Ⅰ中浓硫酸与亚硫酸钠反应产生二氧化硫气体,同时生成硫酸钠和水,其化学方程式为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;(2)如果用稀硫酸,则生成的二氧化硫会溶解在溶液中而难以逸出,所以不能用稀硫酸代替浓硫酸;(3)从装置Ⅱ中溶液中获得已析出的晶体,采取的方法是过滤;(4)装置Ⅲ用于处理尾气SO2,由于SO2属于酸性氧化物,除去尾气SO2应选择碱性溶液,a装置无气体出口,不利于气体与稀氨水充分接触,a不选;要选择d,既可有效吸收,又可防止倒吸,反应的方程式为2NaOH+SO2==Na2SO3+H2O;(5)①由题设滴定反应的化学方程式知,样品中抗氧化剂的残留量(以SO2计算)与I2的物质的量之比为1∶1,n(SO2)=n(I2)=0.01000mol·L-1×0.03L=0.0003mol,残留量=![]() =0.192g·L-1;②由于实验过程中有部分HI被氧化生成I2,4HI+O2==2I2+2H2O,则用于与SO2反应的I2减少,故实验结果偏低。
=0.192g·L-1;②由于实验过程中有部分HI被氧化生成I2,4HI+O2==2I2+2H2O,则用于与SO2反应的I2减少,故实验结果偏低。


科目:高中化学 来源: 题型:
【题目】与下列事实对应的化学用语错误是( )
A.纯碱溶液能清洗油污:CO32﹣+H2OHCO3﹣+OH﹣
B.配制FeSO4溶液时加入适量的铁粉:Fe3++Fe→2Fe2+
C.含1molNaOH和1molNa2CO3的混合溶液中滴入含1.5molHCl的稀盐酸:2OH﹣+CO32﹣+3H+→HCO3﹣+2H2O
D.NH4Al(SO4)2溶液中滴入Ba(OH)2溶液至SO42﹣恰好沉淀完全:2Ba2++4OH﹣+Al3++2SO42﹣→2BaSO4↓+AlO2﹣+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现在污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚(![]() ),其原理如图所示,下列说法正确的是( )
),其原理如图所示,下列说法正确的是( )
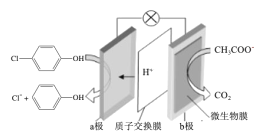
A.b为电池的正极,发生还原反应
B.电流从b极经导线、小灯泡流向a极
C.当外电路中有0.2mole-转移时,a极区增加的H+的个数为0.2NA
D.a极的电极反应式为:![]() +2e-+H+=Cl-+
+2e-+H+=Cl-+![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三元催化转化器能同时净化汽车尾气中的碳氢化合物(HC)、一氧化碳(CO)及氮氧化合物(NOx)三种污染物。催化剂选择铂铑合金,合金负载量不同时或不同的工艺制备的合金对汽车尾气处理的影响如图所示。下列说法正确的是
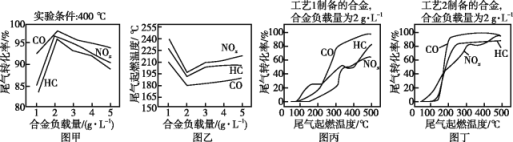
A.图甲表明,其他条件相同时,三种尾气的转化率随合金负载量的增大而增大
B.图乙表明,尾气的起燃温度随合金负载量的增大而降低
C.图甲和图乙表明,合金负载量越大催化剂活性越高
D.图丙和图丁表明,工艺2制得的合金的催化性能优于工艺1制得的合金
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学研究发现,高度对称的有机分子具有致密性高、稳定性强、张力能大等特点。饱和烃中有一系列高度对称结构的烃,如![]() (正四面体烷C4H4)、
(正四面体烷C4H4)、![]() (棱晶烷C6H6)、
(棱晶烷C6H6)、![]() (立方烷C8H8),下列有关说法正确的是
(立方烷C8H8),下列有关说法正确的是
A.上述三种物质中的C原子都形成4个单键,因此它们都属于烷烃
B.上述三种物质互为同系物,它们的通式为C2nH2n(n≥2)
C.棱晶烷与立方烷中碳原子均为饱和碳原子,其二氯代物的数目不同
D.棱晶烷与立方烷在光照条件下均可与氯气发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某企业以辉铜矿为原料生产碱式碳酸铜,工艺流程如下所示:

已知:[Cu(NH3)4]2+(aq) ![]() Cu2+(aq) + 4NH3(aq)根据以上工艺流程,下列说法不正确的是
Cu2+(aq) + 4NH3(aq)根据以上工艺流程,下列说法不正确的是
A.气体X中含有SO2
B.为实现溶液C到溶液D的转化,加NH3·H2O至红棕色沉淀刚好完全,过滤即可
C.蒸氨过程发生总反应的化学方程式为:[Cu(NH3)4 ]Cl2 + H2O![]() CuO + 2HCl↑+ 4NH3↑
CuO + 2HCl↑+ 4NH3↑
D.在制备产品时,溶液D中不直接加入Na2CO3溶液的原因是游离的Cu2+浓度太低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钕铁硼磁铁是最常使用的稀土磁铁,被广泛应用于电子产品中。生产钕铁硼磁铁的主要原材料有稀土金属钕、纯铁、铝、硼以及其他物质。请回答下列问题:
(1)钕(Nd)为60号元素,在元素周期表中位于第____周期;基态Fe2+外围电子的轨道表达式为_____________。
(2)实验测得AlCl3的实际存在形式为Al2Cl6,其分子的球棍模型如图所示。

①该分子中Al原子采取______杂化。
②Al2Cl6与过量NaOH溶液反应生成Na[Al(OH)4],[Al(OH)4]-中存在的化学键有____(填标号)。
A.离子键 B.极性共价键 C.金属键 D.非极性共价键 E.氢键
(3)FeO是离子晶体,其晶格能可通过如下的Born﹣Haber循环计算得到。

基态Fe原子的第一电离能为___kJ·mol-1,FeO的晶格能为___kJ·mol-1。
(4)因材料中含有大量的钕和铁,容易锈蚀是钕铁硼磁铁的一大弱点,可通过电镀镍(Ni)等进行表面涂层处理。已知Ni可以形成化合物四羰基镍[Ni(CO)4],其为无色易挥发剧毒液体,熔点为-25 ℃,沸点为43 ℃,不溶于水,易溶于乙醇、苯、四氯化碳等有机溶剂,四羰基镍的晶体类型是_______,写出与配体互为等电子体的分子和离子的化学式为_____、_____(各写一种)。
(5)已知立方BN晶体硬度很大,其原因是________;其晶胞结构如图所示,设晶胞中最近的B、N原子之间的距离为a nm,阿伏加德罗常数的值为NA,则晶体的密度为_____g·cm-3(列式即可,用含a、NA的代数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中,进行如下反应:NO(g)+CO(g)![]()
![]() N2(g)+CO2(g);△H=﹣373.2kJ/mol达到平衡后,为提高NO的转化率,采取的正确措施是( )
N2(g)+CO2(g);△H=﹣373.2kJ/mol达到平衡后,为提高NO的转化率,采取的正确措施是( )
A. 加催化剂B. 充入CO增大压强C. 充入N2D. 升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。现向一密闭容器中充入1mol N2和3mol H2,在一定条件下使该反应发生:N2+3H2![]() 2NH3。下列有关说法正确的是( )
2NH3。下列有关说法正确的是( )
A. 达到化学平衡时,正反应和逆反应的速率都为零
B. 当符合:3正N2=正H2时,反应达到平衡状态
C. 达到化学平衡时,单位时间消耗a molN2,同时生成3a molH2
D. 当N2、H2、NH3的分子数比为1∶3∶2,反应达到平衡状态
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com