
【题目】在恒容密闭容器中,进行如下反应:NO(g)+CO(g)![]()
![]() N2(g)+CO2(g);△H=﹣373.2kJ/mol达到平衡后,为提高NO的转化率,采取的正确措施是( )
N2(g)+CO2(g);△H=﹣373.2kJ/mol达到平衡后,为提高NO的转化率,采取的正确措施是( )
A. 加催化剂B. 充入CO增大压强C. 充入N2D. 升高温度
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案科目:高中化学 来源: 题型:
【题目】烟气中主要污染物为SO2、NO、NO2,可用如图工艺进行脱硫脱硝及产物回收。
(1)空气预处理过程中,发生主要反应的化学方程式为_______。
(2)洗气过程中,尿素作还原剂,转化成两种无污染的气体的化学式是_______
(3)充分曝气氧化过程中,发生反应的含镁化合物是_________。
(4)完成沉镁过程中生成碱式碳酸镁的离子方程式___Mg2++____= MgCO3Mg(OH)2↓+__CO2↑+____H2O
(5)(NH4)2SO4粗品中含有的主要杂质为_________(填名称)。
(6)碱式碳酸镁经过简单加工可循环利用,加工过程发生反应的化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为长式周期表的一部分,其中的编号代表对应的元素。
① | |||||||||||||||||
② | ③ | ||||||||||||||||
④ | ⑤ | ⑥ | ⑦ | ⑧ | |||||||||||||
⑨ | ⑩ |
请回答下列问题:
(1)表中⑨号属于______ 区元素。
(2)表中元素③的2个原子与元素①的2个原子形成的某种直线型分子名称为 ________ ; ③和⑧形成的一种常见溶剂,其分子立体空间构型为________ 。
(3)元素①和⑥形成的最简单分子X属于 ________ 分子(填“极性”或“非极性”)。
(4)元素⑥的第一电离能 ________ 元素⑦的第一电离能;元素②的电负性________ 元素④的电负性(选填“>”、“=”或“<”)。
(5)元素⑨的基态原子核外价电子排布式是 ________ 。
(6)元素⑧和④形成的化合物的电子式为 ________ 。
(7)某些不同族元素的性质也有一定的相似性,如上表中元素⑩与元素⑤的氢氧化物有相似的性质。请写出元素⑩的氢氧化物与NaOH溶液反应的化学方程式:________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列各组物质制备和收集气体,能采用如图装置的是

A.浓氨水与生石灰反应制NH3
B.浓盐酸与二氧化锰反应制Cl2
C.过氧化氢溶液与二氧化锰反应制O2
D.FeS与稀硫酸反应制H2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某容积固定的密闭容器中加入0.3molA、0.1molC和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的平均相对分子质量没有变化。请回答下列问题。
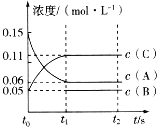
(1)密闭容器的容积是___L。
(2)若t1=15s,则t0~t1阶段以C物质浓度变化表示的反应速率为v(C)=___。
(3)写出反应的化学方程式:___。
(4)B的起始物质的量是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有等体积混合而成的4组气体.①NO2+NO、②NO2+O2、③HCl+N2、④Cl2+SO2.现将其分别通入体积相同的试管中并立即倒立在足量水中,试管内水面上升的高度分别为h1、h2、h3、h4,则高度关系是
A.h4>h2>h3>h1 B.h4>h3>h2>h1
C.h2>h3>h1>h4 D.h3>h2>h1>h4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请回答以下问题:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
二 | ① | ⑩ | ② | |||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||
四 | ⑧ | ⑨ |
(1)在这些元素中,最活泼的非金属元素是___(元素符号),原子最外层达到稳定结构的元素是__(元素符号);
(2)元素的最高价氧化物对应的水化物中酸性最强的是____(填化学式);
(3)写出④的氧化物与③的最高价氧化物对应的水化物相互反应的化学方程式_____;
(4)③、⑥、⑧的原子半径由大到小为__﹥___﹥__/span>(填元素符号)①、⑤的最高价含氧酸酸性__﹥__(均填化学式);
(5)写出证明非金属性⑥比⑨强(用置换反应证明)的化学方程式________;
(6)写出实验室制备⑩的氢化物的化学方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量混合均匀的铁粉与硫粉在隔绝空气的条件下共热,充分反应后冷却至室温,得到固体A。将质量为m的固体A加入到300 mL 2 mol/L盐酸中使之完全溶解。测得室温下加入固体A的质量与收集到气体体积(已换算成标准状况)的关系如右图所示(假设所得氢硫酸溶液饱和前无硫化氢气体逸出)。已知:
①加入固体A的质量m≤3.2 g时,收集到的气体为H2;
②当m>3.2 g时,收集到的气体为H2和H2S的混合气体。
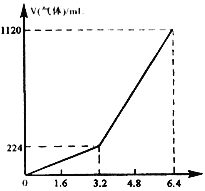
⑴3.2 g固体A中所含的物质有______________。
⑵3.2 g固体A中各物质的物质的量分别为______________,溶于上述盐酸充分反应后,所得溶液中氢硫酸的物质的量浓度为______________(忽略溶液体积的变化)。
⑶当固体A全部溶于上述盐酸,且A的质量m>3.2 g时,收集到的气体体积(标准状况下)V=______________mL(用含m的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某种燃料含有碳、氢、氧三种元素。为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的O2中燃烧,并将产生的气体全部通过图示装置,得到如表所列的实验数据(产生的气体完全被吸收)。

实验前 | 实验后 | |
(干燥剂+U形管)的质量 | 101.1g | 102.9g |
(澄清石灰水+广口瓶)的质量 | 312.0g | 314.2g |
根据实验数据填空:
(1)实验完毕后,生成物中水的质量为____g,假设广口瓶里生成一种正盐,其质量为______g。
(2)生成的水中氢元素的质量为________g。
(3)生成的CO2中碳元素的质量为________g。
(4)该燃料中碳、氢元素质量比为________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com