
【题目】利用下列各组物质制备和收集气体,能采用如图装置的是

A.浓氨水与生石灰反应制NH3
B.浓盐酸与二氧化锰反应制Cl2
C.过氧化氢溶液与二氧化锰反应制O2
D.FeS与稀硫酸反应制H2S
【答案】C
【解析】
根据装置图可知,该反应装置中反应物可以是固液混合物,且不需要加热,采用向上排空气法收集气体,则收集的气体密度大于空气的密度且与氧气不反应,据此分析解答。
A. 氨气的密度小于空气的密度,应采用向下排空气法收集,A项错误;
B. 浓盐酸和二氧化锰反应制取氯气需要加热,B项错误;
C. 过氧化氢在二氧化锰的催化作用下反应制取氧气,不需要加热,且氧气密度大于空气的密度,符合条件,C项正确;
D. 实验室通常用硫化亚铁(FeS)与稀硫酸制取硫化氢气体,发生装置属于固体和液体不加热制取气体,硫化氢密度比空气大,可以采用向上排空气法收集,但硫化氢有毒,缺少尾气处理装置,D项错误;
答案选C。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】某烃A,相对分子质量为140,其中碳的质量分数为0.857。A分子中有两个碳原子不与氢直接相连。A在一定条件下氧化只生成G,G能使石蕊试液变红。

试写出:
(1)A的分子式___________________。
(2)化合物A和G的结构简式: A___________________,G___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W为五种短周期元素。X原子的质子数与电子层数相同,W原子核外电子数是M原子最外层电子数的2倍,Y、Z、M、W在周期表中的相对位置如图所示。下列说法不正确的是

A. 原子半径:W>Y>Z>M>X
B. 热稳定性:XM>X2Z,沸点:X2Z>YX3
C. X、Y、Z三种元素形成的化合物中不可能含离子键
D. YM3、WM4分子中每个原子最外层均满足8电子结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的单质及一些化合物在工农业生产等领域有重要应用,回答下列问题
(1)羟胺 ( 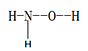 ) 是不稳定的白色大片状或针状结晶。极易吸潮,极易溶于水。
) 是不稳定的白色大片状或针状结晶。极易吸潮,极易溶于水。
①羟胺分子中采用sp3杂化的原子是____________________;羟胺极易溶于水,主要原因是________________________________。
②在羟胺的组成的元素中,处于同一周期元素的第四电离能(I4)较大的是______________(用元素符号表示)。
(2) 吡啶![]() 和邻啡罗啉都是含氮的有机物,l mol吡啶中含有
和邻啡罗啉都是含氮的有机物,l mol吡啶中含有![]() 键的物质的量为_________ mol。
键的物质的量为_________ mol。
(3)已知:每1mol下列物质分解为气态基态原子消耗能量分别为
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
①NO2 + CO ![]() CO2 + NO
CO2 + NO
②N2(g)+O2(g) ![]() 2NO(g) ΔH=+179.5 kJ/mol
2NO(g) ΔH=+179.5 kJ/mol
③2NO(g) +O2(g)![]() 2NO2(g) ΔH=-112.3 kJ/mol
2NO2(g) ΔH=-112.3 kJ/mol
试写出NO与CO反应生成无污染物气体的热化学方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型的“锂-呼吸CO2电池”,结构如图所示,下列说法不正确的是
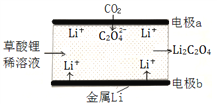
A. 该装置是化学能转变为电能
B. 利用该技术可减少温室气体CO2的排放
C. 正极的电极反应为:2CO2 + 2e- = C2O42-
D. 每生成10.2g Li2C2O4,有0.2mol Li+从正极迁移至负极
【答案】D
【解析】A、该装置为原电池装置,将化学能转化为电能,故A正确;B、由图可知,CO2转化为C2O42-,可减少温室气体的排放,故B正确;C、CO2→C2O42-,碳元素化合价降低,得电子,则CO2在正极发生反应,电极反应为:2CO2 +2e-=C2O42-,故C正确;D、原电池中,阳离子向正极移动,故D错误。故选D。
【题型】单选题
【结束】
27
【题目】用惰性电极电解足量下列溶液一段时间后,再加入一定量括号内的纯净物,能使溶液恢复到原来的成分和浓度的是
A. AgNO3[AgNO3] B. NaOH[NaOH] C. KCl[H2O] D. CuSO4[CuO]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性锌锰干电池在放电时,电池的总反应方程式可以表示为: Zn+2MnO2 +2H2O = Zn(OH)2 +2MnOOH。电池放电时,负极上发生反应的物质是
A.Zn B.碳棒 C.MnO2 D.MnO2和H2O
【答案】A
【解析】
试题分析:根据总反应方程式可知Zn在反应中失去电子,发生氧化反应,所以作原电池的负极,MnO2得到电子,发生还原反应,作原电池的正极。因此答案是选项A。
考点:考查根据原电池反应原理确定电池的电极材料的知识
【题型】单选题
【结束】
17
【题目】在恒容隔热容器中,下列说法可以证明可逆反应N2+3H2![]() 2NH3已达到平衡状态的是( )
2NH3已达到平衡状态的是( )
①1mol N≡N键断裂的同时,有6mol N-H键断裂
②v(H2)=0.9 mol·L-1·min-1,v(NH3)=0.6 mol·L-1·min-1
③保持其他条件不变时,体系气体密度不再改变
④NH3、N2、H2的体积分数都不再改变
⑤体系温度不再改变
A. ②③④ B. ①③⑤ C. ①④⑤ D. ③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中,进行如下反应:NO(g)+CO(g)![]()
![]() N2(g)+CO2(g);△H=﹣373.2kJ/mol达到平衡后,为提高NO的转化率,采取的正确措施是( )
N2(g)+CO2(g);△H=﹣373.2kJ/mol达到平衡后,为提高NO的转化率,采取的正确措施是( )
A. 加催化剂B. 充入CO增大压强C. 充入N2D. 升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸溶液中存在电离平衡CH3COOH![]() H++CH3COO-,不正确的是( )
H++CH3COO-,不正确的是( )
A. 醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-)
B. 常温下0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)减小
C. CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
D. 常温下pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲用NaOH固体配制1.0molL-1的NaOH溶液230mL:
(1)配制溶液时,一般可以分为以下几个步骤:(完成下列空格)
A.计算;B.称量;C.___;D.冷却;E.移液;F.___;G.定容;H.摇匀、装瓶。
(2)本实验必须用到的仪器有天平、药匙、玻璃棒、烧杯、胶头滴管、量筒、还有___mL容量瓶,使用容量瓶前必须进行的一步操作是___。
(3)需称量___g烧碱固体,固体应该放在___中称量。
(4)在配制过程中,其他操作都是正确的,下列操作会引起浓度偏高的是___。
A.没有洗涤烧杯和玻璃棒
B.转移溶液时不慎有少量洒到容量瓶外面
C.容量瓶不干燥,含有少量蒸馏水
D.定容时俯视刻度线
E.未冷却到室温就将溶液转移到容量瓶并定容
(5)若从所配制溶液取出100mL,再将这100mL溶液加水稀释成1L的溶液,则稀释后所得溶液的物质的量浓度为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com